こんにちは。Horyです。
前回の記事ではアミノ酸の電離に関して中性・酸性・塩基性における違いを解説しました。
この中でアミノ酸の等電点に関して話したと思います。
等電点とは水溶液や結晶中のアミノ酸において、陽イオンと陰イオンの数が等しくなって電気的に中性となるpHのことを言います。
今回の記事では等電点のpHを計算によって求めたいと思います。
今回も頑張りましょう。
アミノ酸の等電点
アミノ酸はアミノ基とカルボキシ基が共存する分子です。
水溶液中や結晶中でアミノ基は陽イオンに、カルボキシ基が陰イオンになって陽イオンと陰イオンが共存する双性イオンになることは前回の記事でも解説しました。
等電点とは電離後に全体の電荷が0になるpHのことです。
つまり、陽イオンと陰イオンの数が等しくなります。
等電点では中性なα-アミノ酸の濃度が最大になります。
- 中性アミノ酸
- 酸性アミノ酸
- 塩基性アミノ酸
上の3つのアミノ酸の等電点を計算で個別に求めます。
ここで、簡単のためにアミノ酸の化学式をXで置き換えます。
中性アミノ酸の等電点
中性アミノ酸の電離は二段階に分かれます。

- 式①の平衡定数;K1
- 式②の平衡定数;K2
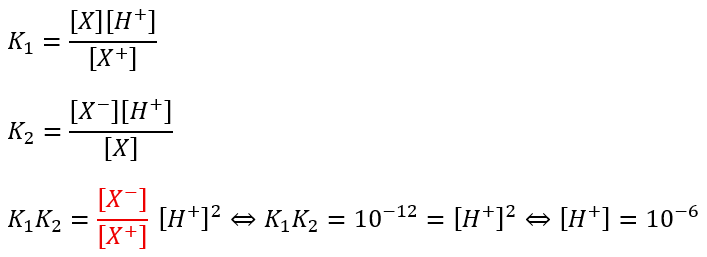
上の場合はアラニンの時で等電点のpHは6になります。
酸性アミノ酸の等電点
酸性アミノ酸の等電点は3段階に分かれます。

ここで、式が3つあってどうやってやんの?と思うかもしれませんが・・・
③の平衡定数は非常に小さいです。
これはどういうことかと言うと、二価の陰イオンの数が非常に少ないと言うことを意味します。
なので、③の式は無視して良いです(無視出来ない場合は丁寧な誘導に従ってください)。
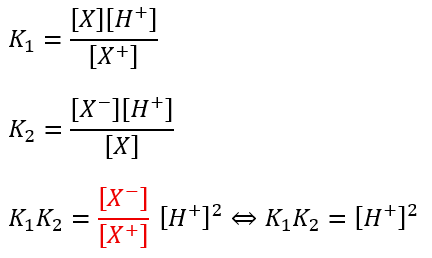
塩基性アミノ酸の等電点
塩基性アミノ酸の等電点も結局は同じです。

②や③の平衡定数と比較して①の平衡定数は非常に大きいです。
これが意味するところは2価の陽イオンの数が非常に少ないと言うことを意味しています。
そのため、①は無視することが出来ます。
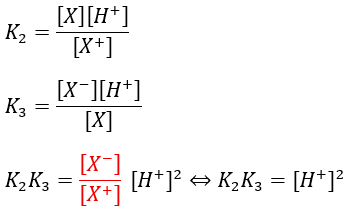
アミノ酸と電気泳動
ここで、アミン酸と電気泳動についても簡単に解説します。
言葉通りに説明すると、アミノ酸に電気を加えると泳ぐように動くと言うことです。
- アミノ酸の溶液に電極
- アミノ酸に電気を加える
- 電荷を帯びた溶質分子(アミノ酸分子)が移動 (pHで異なる反応)
- 陽イオンが多い・・・陰極に移動
- 陰イオンが多い・・・陽極に移動
- 双性イオンが多い・・・動かない
これはアミノ酸が中性か酸性か塩基性かで等電点が異なるので同じpHでもアミノ酸の種類によって挙動が異なります。



コメント