こんにちは。Horyです。
前回の記事では高校化学で覚えておくべき20種類のアミノ酸をまとめました。
この中でアミノ酸が中性と酸性と塩基性に分けられることも話したと思います。
これらの違いの詳細を理解するためにはそれぞれのアミノ酸の電離の仕方を理解する必要があります。
今回も頑張りましょう。
α-アミノ酸と双性イオン
アミノ酸はアミノ基があるカルボン酸です。
そのため、分子中にアミノ基とカルボキシ基が共存していることが重要です。
これが結晶中でどうなるかということを図にしてみます。
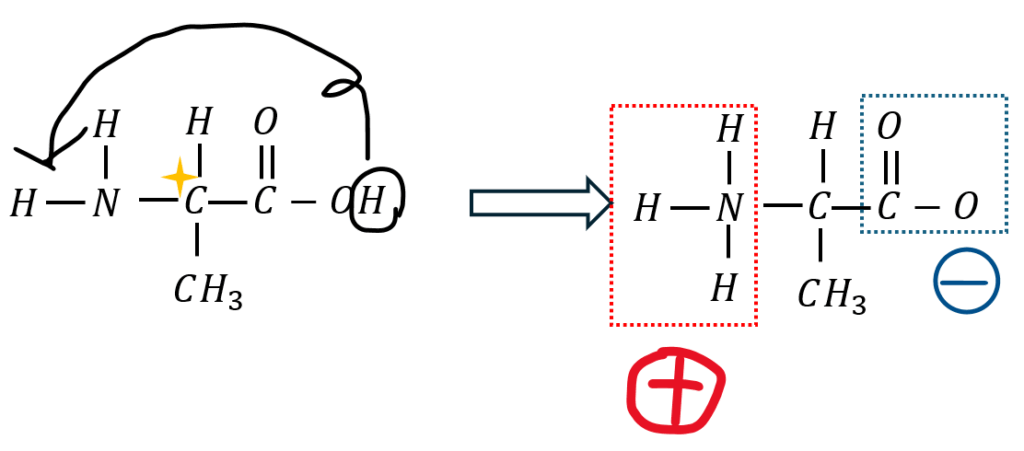
何が起こっているかを順序立てて説明します。
- 結晶・中性にてCOOHののび太(H)はしずかちゃん(N)とくっつきたい
- Hがイオンになってアミノ基に配位結合する
- NH2→NH3になって陽イオンに
- COOH→COOになって陰イオンに
- 結晶中に陽イオンと陰イオンが共生する
上の図に示すように結晶中に陽イオンと陰イオンが共存するような形態を双性イオンと呼びます。
図のように双性イオンが多数集まってアミノ酸の結晶が出来ますが、結晶が擬似的なイオン結合で繋がっています。
イオン結合をしている物質は融点が高くなる傾向があります。
アミノ酸が有機化合物であるにも関わらず融点が非常に高いのはこれが理由です(これは論述問題で出ることがあるので覚えといた方が良い)。
アミノ酸の電離
アミノ酸の電離について以下の項目で個別にまとめたいと思います。
- 中性アミノ酸
- 酸性アミノ酸
- 塩基性アミノ酸
中性アミノ酸と電離平衡
中性アミノ酸の電離平衡を図にします。
電離は二段階あります(図ではアラニンを例に解説します)。
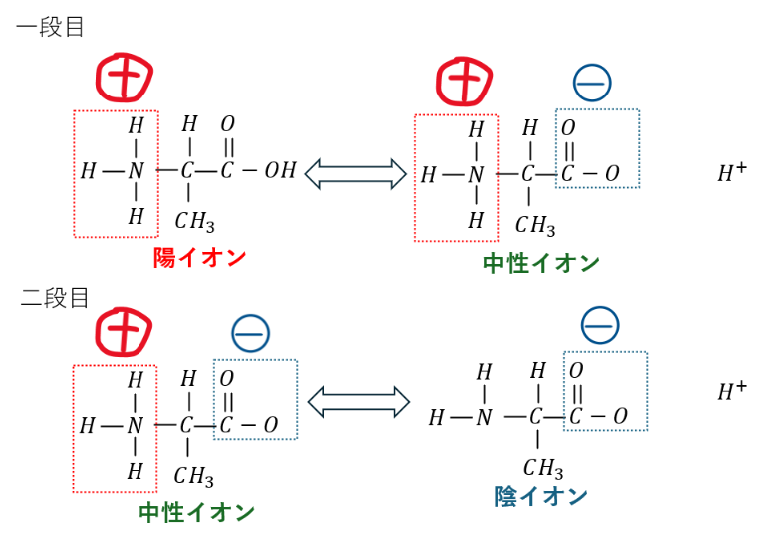
ここで、ルシャトリエの原理を思い出してください。変化を妨げる方向に平衡は移動します。
- 水溶液が中性・・・平衡の移動なし→中性イオン
- 水溶液が酸性・・・水素イオンを減らす方に→平衡は左に→陽イオン
- 水溶液が塩基性・・・水素イオンを増やす方に→平衡は右に→陰イオン
中性アミノ酸の等電点がpH 6~7である理由です。
酸性アミノ酸と電離平衡
酸性アミノ酸の電離を図にします。
電離は三段階あります(図ではアスパラギン酸を例に解説)。
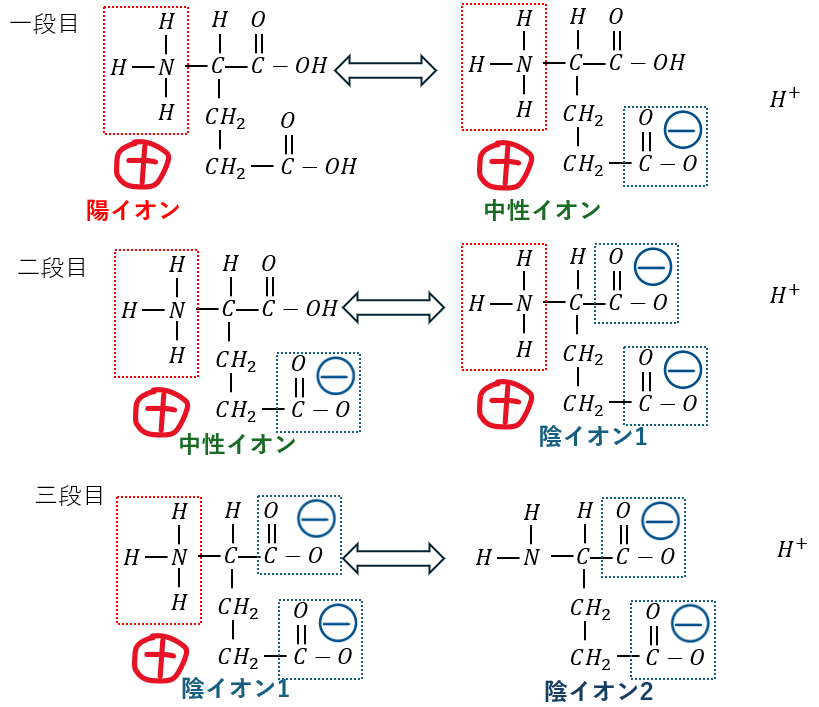
- 水溶液が酸性・・・水素イオンを減らす方に→平衡は左に
- 水溶液が中性・・・陰イオン1が多い (電気的にマイナス)
- 水溶液が塩基性・・・陰イオン2が多い (電気的にマイナス)
酸性アミノ酸の等電点pHが低いのはこのためです。
塩基性アミノ酸と電離平衡
塩基性アミノ酸の電離を図にします。
電離は三段階あります(図ではリシンを例に解説)。
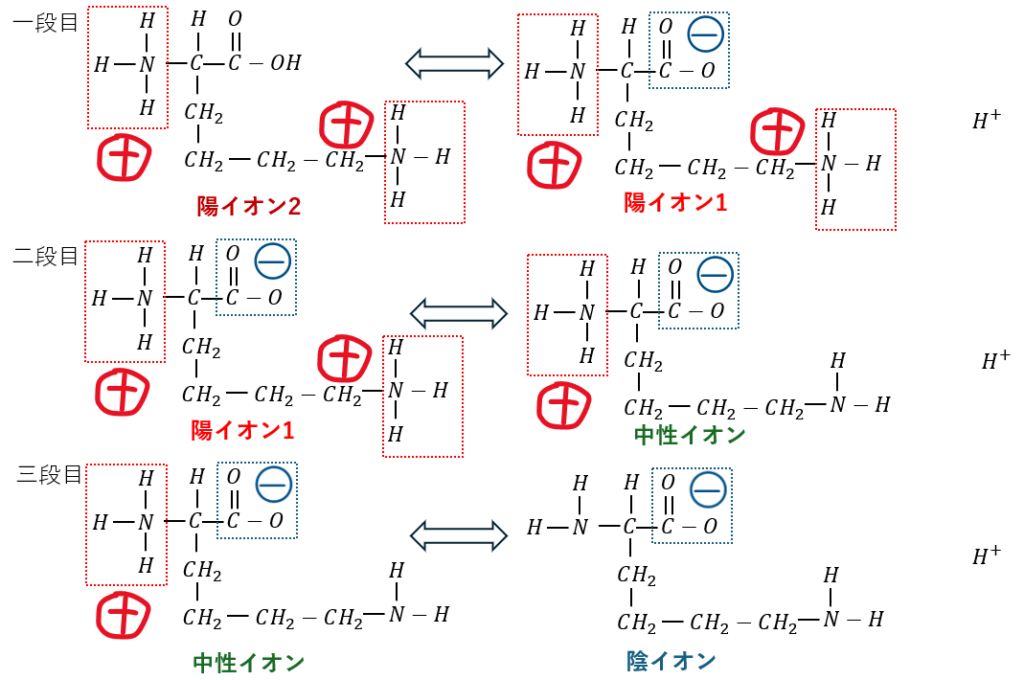
- 水溶液が酸性・・・陽イオン2が多い (電気的にプラス
- 水溶液が中性・・・陽イオン1が多い (電気的にプラス)
- 水溶液が塩基性・・・水素イオン多い→平衡が左に
塩基性アミノ酸の等電点pH高いのはこのためです。



コメント