こんにちは。Horyです。
前回の記事ではベンゼンの求電子置換反応の原理とベンゼンのクロロ化/アルキル化/アセチル化について解説しました。
求電子置換反応に関しては前回の記事を読めば良いだけなので今回の記事では解説しません。
今回の記事ではベンゼンのニトロ化とスルホン化について解説します。
ニトロベンゼンは爆弾の原料としても有名です。
今回も頑張りましょう。
ベンゼンのニトロ化/スルホン化
それぞれについて反応のプロセスを解説します。
この反応に関わる陽イオンは以下の通りです。
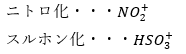
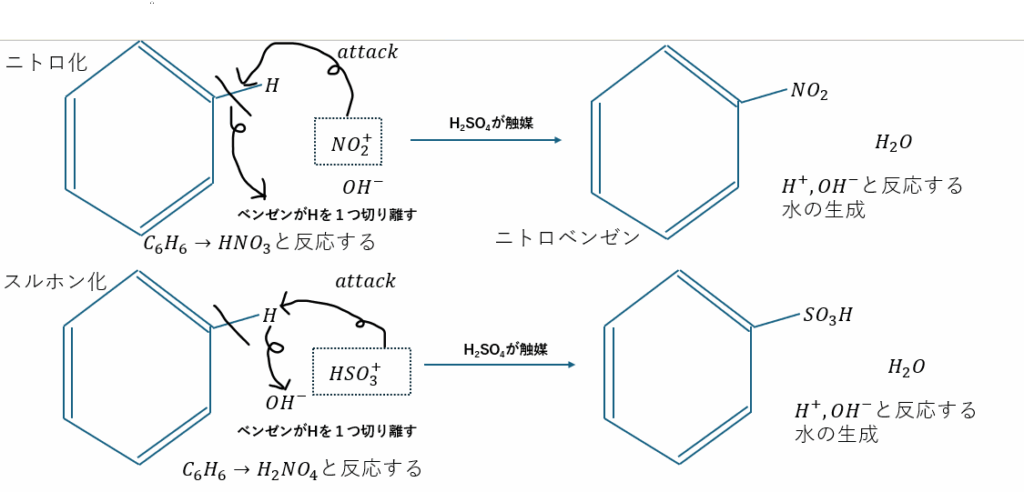
- ベンゼンのニトロ化
- 触媒として濃硫酸を準備(濃硝酸でもOK)
- ベンゼンとHNO3を反応
- 求電子置換反応により脱水が進行
- ニトロベンゼンと水の生成
- ベンゼンのスルホン化
- 触媒として濃硫酸を準備
- ベンゼンとH2SO4(触媒とは別)を反応
- 求電子置換反応により脱水が進行
- ベンゼンスルホン酸と水の生成
これらをそれぞれ図に示してみます。
上の反応について細かな部分を掘り下げてみようと思います。
触媒が濃硫酸である理由
触媒が濃硫酸や濃硝酸である理由を解説します。
こちらの記事でも解説したと思いますが、濃硫酸に含まれる水の量は非常に少ないです。
そのため、電離が進行しません。
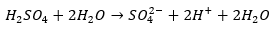
上の反応が進行せず、水素イオンを出さないので反応に影響を与えません。だから、触媒として濃度が高い濃硫酸が最適なのです。
また、酸としての強さの序列は以下の通りです。
- 硫酸第一電離>>>塩酸>>硝酸>>硫酸第二電離
酸としての強さは酸を水に投入した後に水素イオン(のび太)をどの程度手放したいかです。
上の酸の強さは覚えておいた方が良いです。
ニトロ化の陽イオンを作る方法
ベンゼンのニトロ化で陽イオンを生成する方法を教えます。
手順は以下の通りです。
- 濃硫酸:濃硝酸=3:1の酸(混酸)を用意
- 硫酸由来の水素イオン2つが硝酸に攻撃
- オキソニウムイオンとニトロイオンの生成
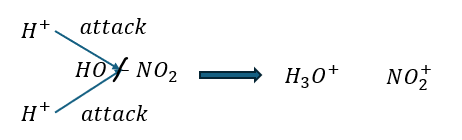



コメント