こんにちは。Horyです。
皆さんはフェノールという有機化合物をご存知でしょうか?
表紙の画像にもなっているブドウやワインにもフェノール化合物は含まれています。
ベンゼン環にヒドロキシ基の付いた物質です。この物質はアルコールと性質が全く違います。
炭化水素にOHが付いた物質とベンゼン環にOHが付いたモノでどうして性質が違うのか疑問に思う人は多いと思います。
今回はフェノールの性質を紹介すると共に、アルコールとの違いの原因を原理から解説します。
今回も頑張りましょう。
フェノールの性質
フェノールとは以下に示すような物質のことです。
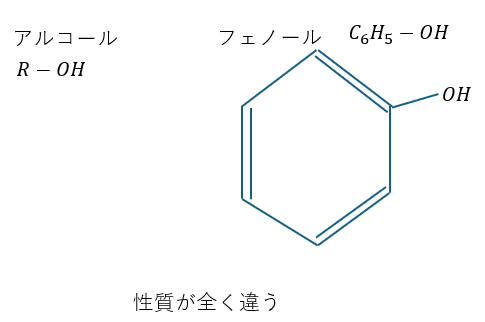
この物質はベンゼン環にOHが付いています(フェノール性ヒドロキシ基)がアルコールとは性質が全く異なります。
アルコールに関する記事はこちらに載っています。
- アルコールの性質
- 中性を示す
- カルボン酸と縮合してエステルを生成
- フェノールの性質
- 酸性を示す
- カルボン酸でエステル化は無理 (無水酢酸などの酸無水物なら可能)
- 塩化鉄(Ⅲ)水溶液で赤紫~青紫に呈色する
アルコールとカルボン酸の縮合(エステル化)についてはこちらの記事に示してあります。
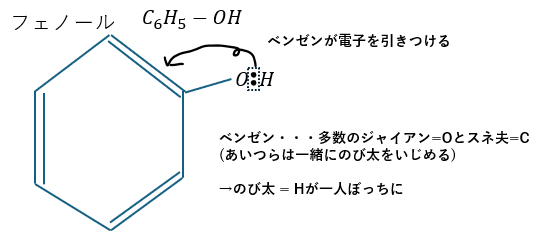
アルコールとフェノールが違う理由は結論から言うと反応性の違いです。この反応性が異なる根本がフェノールのベンゼン環における電子の共鳴にあります。
上の記事にも書きましたが、ベンゼン環の共鳴とは簡単に説明するとベンゼンの二重結合の電子が1つの場所に留まらないために安定することです。
答えを言うと、ベンゼン環の共鳴効果がフェノール性ヒドロキシ基に及ぶためです。
フェノールが酸性
アルコールが中性にも関わらずフェノールが酸性なのは不思議に思う人も多いと思います。
そもそも酸性と中性にはどういう違いがあるのでしょうか?
- 酸性の原理
- 水溶液中に物質が存在する
- 電離により水素イオンの割合が多くなる
- 水溶液が酸性を示す
- 中性の原理
- 水溶液中に物質が存在する
- 電離しないor電離してもHイオンやOHイオンが存在しない
- 水溶液中のHイオンとOHイオンの量が等しくなる
- 水溶液が中性を示す
つまり、フェノールが酸性を示すのは水溶液中でフェノールのOHのHが電離しやすいためです。
この原理がベンゼン電子の共鳴にあって共鳴によりO-Hの結合電子が引きつけられます。
分かりやすく説明すると、ベンゼン (大人数のジャイアンとスネ夫)が他の場所の電位まで奪おうとするのです。
カルボン酸でエステル化が不可
初めにアルコールがカルボン酸と縮合してエステル化する原理を復習します。
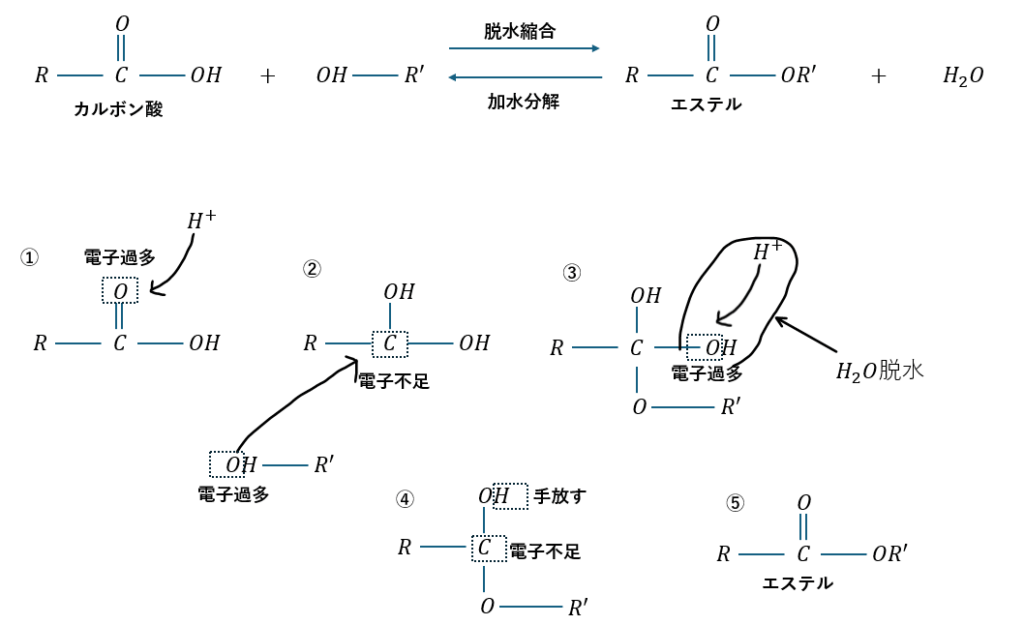
アルコールのOHのOの非共有電子対を狙ってカルボン酸がアルコールに近づいてエステル化します。
フェノールの場合を示します。
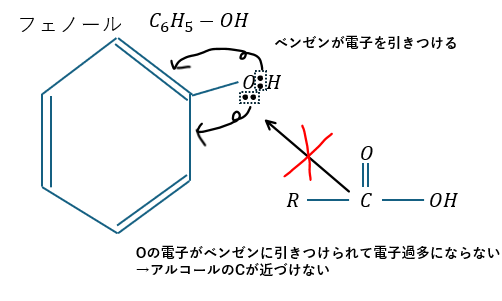
共鳴はOHの非共有電子対も引きつけます。だから、Oは電子過多にならないのでアルコールのCが近づけないのです。
逆に、酸無水物(無水酢酸)であればCの正電荷が強いのでベンゼンの共鳴に負けずに近づくことが可能です。
塩化鉄(Ⅲ)による呈色
フェノールは塩化鉄(Ⅲ)水溶液で赤紫~青紫色に呈色します。
この原因もベンゼン環の共鳴にあります。
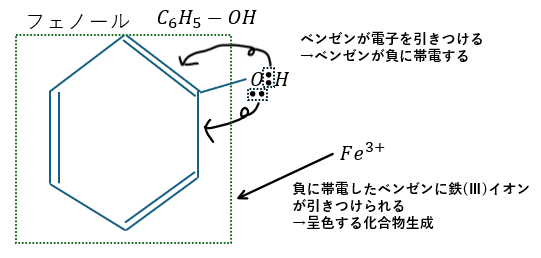
今度はベンゼン環が共鳴で電子を引きつけることで負に帯電したベンゼンに鉄の陽イオンが引きつけられて呈色する有機化合物ができます。
これは、ベンゼンに直接OHが付いた化合物(フェノール性ヒドロキシ基)の検出反応になります。
覚えといてください。
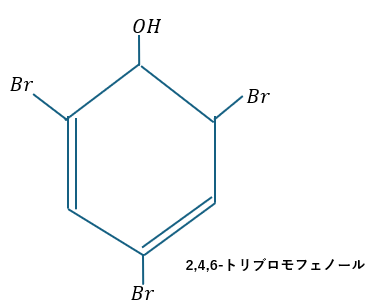
ちなみに、塩化鉄水溶液以外でも臭素水でフェノールを検出する方法もあります(2,4,6-トリブロモフェノールの白色沈殿)。


コメント