こんにちは。Horyです。
前回までは有機化学で脂肪族に関してまとめていましたが、今回から芳香族に関する記事になります。
その第一歩として今回はベンゼンの歴史をまとめると共に性質を解説します。
今回も頑張りましょう。
ベンゼンの基礎
まず、こちらの記事でも簡単に解説しましたが、芳香族とはCが環を作る化合物でベンゼン環を含むモノを言います。
ベンゼン環は以下の図に示すような構造をしています。
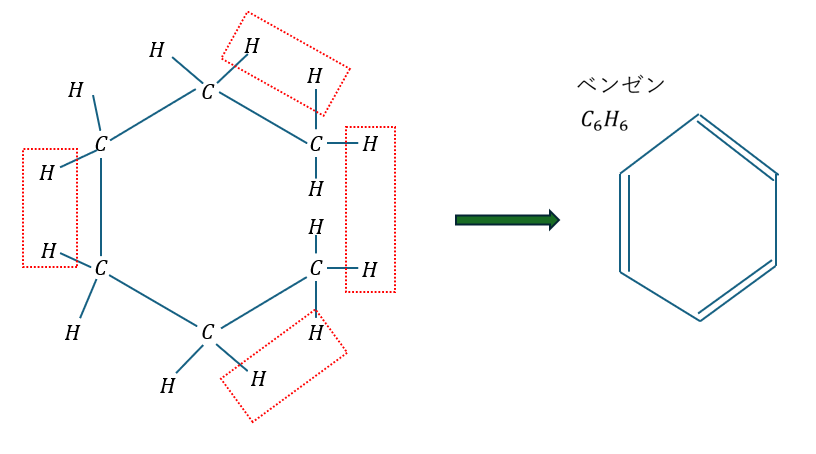
以下のことは覚えた方が良いです。
- ベンゼンの分子量・・・78
- ベンゼンの不飽和度・・・4
不飽和度に関する記事はこちらです。
- 分子量覚えると・・・ベンゼンにどんな官能基がついた芳香族化合物か分かる
- 不飽和度・・・4以上だとベンゼン環ある可能性高い
ベンゼンの歴史と基礎
まずは、ベンゼン発見の歴史を解説します。
- 1825;鯨油の熱分解でベンゼンを発見
- 1834;分子量の特定成功
- 1865;六員環であり、単結合と二重結合が交互 (ケクレ構造)
- 量子力学の台頭
- ベンゼンの二重結合は常に移動 (ロビンソン構造)
ところで、皆さんはベンゼン環が以下のように記述されていることを見たことがないでしょうか?
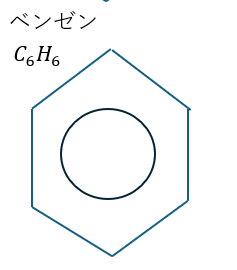
このようにベンゼン環を書いても正解です。
このような描き方ができる理由ですが、量子力学の登場により分子の構造がより詳細に解明されたからです。
どういうことかと言うと、ベンゼンは6個のC原子が正六角形の構造をなしていますが、それらの持つ4つの価電子の内1つは広がって存在していることが分かったのです。
つまり、4つの荷電子のうち1つは1つの所に留まらないと言うことです。この状態を大学の化学では共鳴と呼んでいます。
六角形内の○は電子の共鳴を示しているのです。
まぁ、必要なら、インターネットで「ベンゼン 構造」と調べてみてください。
ベンゼンと共鳴 熱化学方程式
熱化学方程式に関してはこちらの記事をご覧ください。
ベンゼンがシクロヘキサンになる過程を熱化学方程式で表します。
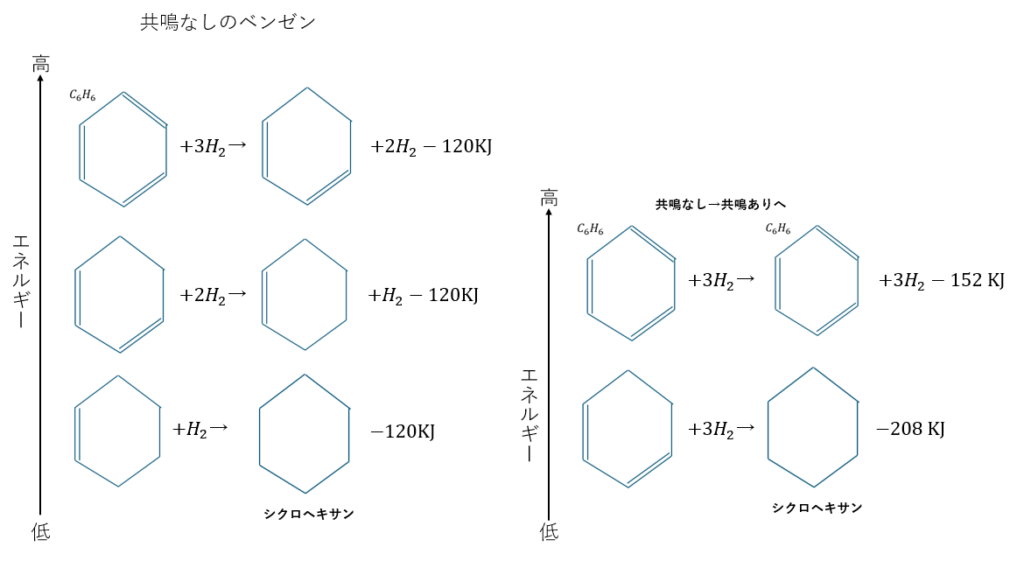
上の図からベンゼンは共鳴していない状態よりも共鳴した状態の方が152KJだけ安定していることが分かります。
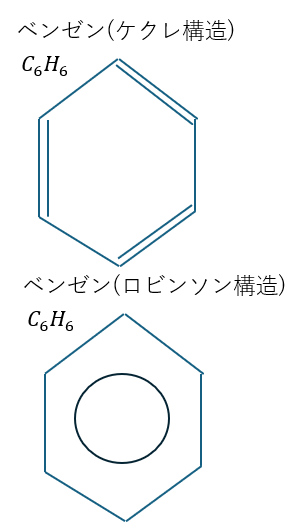
試験ではベンゼン環をケクレ構造・ロビンソン構造のどちらで記述しても減点されることはまずありません(統一した方が良い)。
どちらか好きな方で記述してください(私はケクレ構造が好きなので、今後の記事ではケクレ構造の方で書きます)。



コメント