こんにちは。Horyです。
前回の記事では異性体のことに関して簡単にまとめました。
今回の記事では有機化合物の不飽和度の確認方法について話します。
皆さんは有機化合物の化学式を見たときに「二重結合や環の数がいくつあって、それをすぐに確認できる方法はないだろうか?」と思うことが多々あると思います。
本記事では不飽和度をすぐに確認する方法を教えます。かなりの時短になるので必ず習得していただきたいです。
今回も頑張りましょう。
結合できる水素の数
C,N,Oに結合できる水素原子の数には限りがあります。
横方向に炭素原子が結合して縦方向に水素原子が結合すると考えると・・・
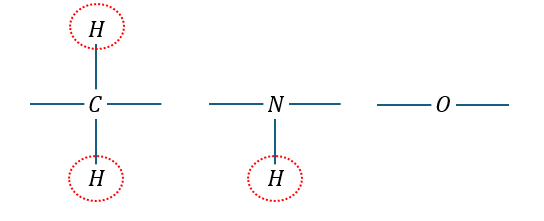
横の二方向には炭素原子が2つ結合しているので・・・
- 炭素(スネ夫)・・・価標は最大4つ・・・水素原子(のび太)は2つ増加
- 窒素(しずかちゃん)・・・価標は最大3つ・・・水素原子(のび太)は1つ増加
- 酸素(ジャイアン)・・・価標は最大2つ・・・水素原子は増加しない
上のことが非常に重要です。
直鎖のアルカンを初めとする飽和化合物を考えたときに、端っこは必ず「H-H」になりますが、この間にC,N,O原子を投入したときに水素原子がどう増えるかを考えます。
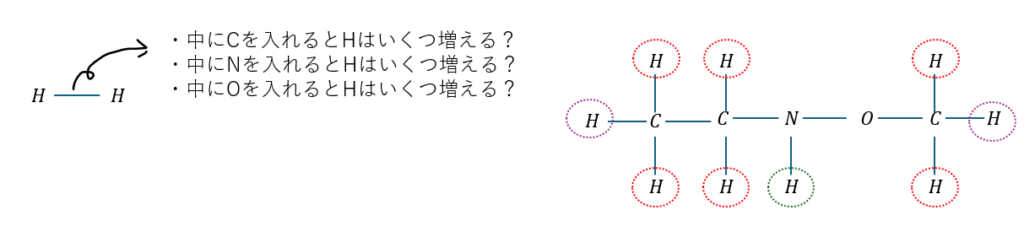
上の図の内容をまとめると・・・
- C原子がX個・・・増加するH原子は2X個である
- N原子がY個・・・増加するH原子はY個である
- O原子がZ個・・・増加するH原子は0個である
- 分子式は・・・CXH2X+2+YNYOZ
- 炭化水素ならCXH2X+2・・・アルカン
飽和結合で何故「+2」になるのかというと端っこの2つの水素原子を数えているからです。
不飽和度について・・・
不飽和度について、以下のカテゴリに分けて考えていきます。
- 二重結合
- 環構造
- ベンゼン環
これら3つについて個別に解説していきます。
二重結合の不飽和度
不飽和度を考えるときは必ず、飽和結合の時の水素原子はいくつであるかを考えてください。
今回は二重結合がひとつできると水素原子が何個減少するかを考えます。
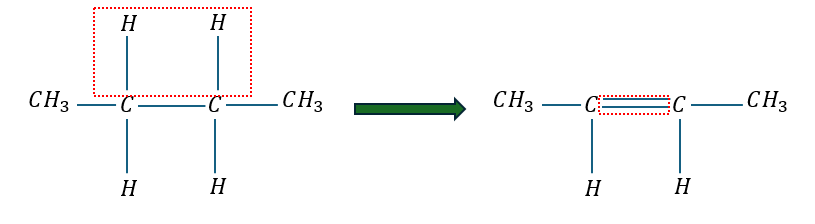
二重結合が1つできると飽和化合物の隣り合う水素原子を2つ減らしていることが分かります。
だから、二重結合は1つできるごとに水素原子は2つ減少します。
実際に二重結合を1つ持つアルケンの分子式はCnH2nと表されてアルカンの水素原子が2つ減っている状態です。
飽和した状態から水素原子が2つ減るごとに不飽和度は1増えます。
よって不飽和度は1です。
ちなみに、三重結合なら1つできるごとに水素原子は飽和している状態から4つ減るので不飽和度は2です(当たり前)。
環構造の不飽和度
環構造の不飽和度を考えます。これも先ほどと同様の考え方です。
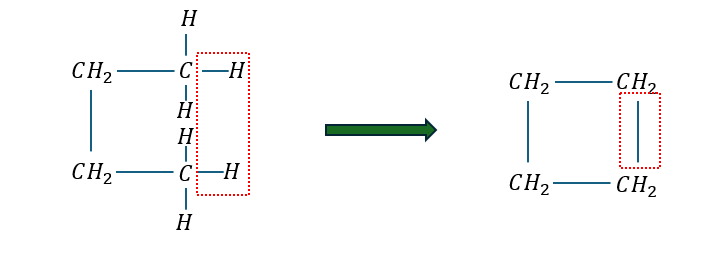
環の時は飽和化合物を折り曲げて考えてください。
これも二重結合と同様に環構造1つに関して水素原子は2つ減ります。
実際に環構造を1つ持つシクロアルカンの分子式はCnH2nと表されてアルカンの水素原子が2つ減っている状態です。
環構造1つにつき不飽和度は1増えます。
よって不飽和度は1です。
ベンゼンの不飽和度
ベンゼンの不飽和度を考えます。同様の考え方を行います。
- ベンゼン;C6H6
- 飽和状態;C6H14
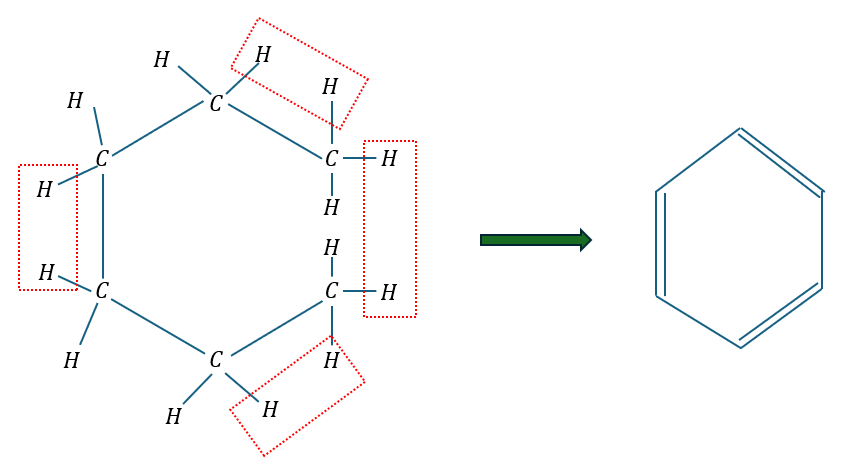
- 二重結合3つ・・・水素原子6つ減少
- 環構造1つ・・・水素原子2つ減少
- 水素原子が計8つ減少→不飽和度4
ベンゼンの不飽和度が4であることは覚えておいた方が良いです。
というのも、高校化学で出てくる不飽和化合物で不飽和度が4以上である物はベンゼン環を持つ可能性が非常に高いです。
不飽和度の計算
不飽和度について簡単にまとめます。
- 不飽和度0・・・二重結合や環構造はない
- 不飽和度1・・・二重結合 or 環を1つ持つ可能性
- 不飽和度2・・・二重結合2つ or 環が2つ or 二重結合と環が1つずつ or 三重結合1つ
- 不飽和度4以上・・・ベンゼン環の可能性が高い
不飽和度の計算方法ですが・・・
- 水素原子の最高原子数 (飽和状態での数)・・・Hm
- 水素原子数の実際数 (与えられた化学式の数)・・・Hr
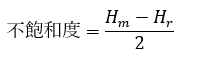
実際に、C4H8はアルケンかシクロアルカンで二重結合or環を1つ持つのですが・・・
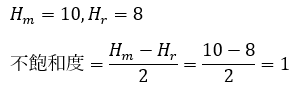
また、ベンゼン環は・・・


コメント