こんにちは。Horyです。
今回の記事は有機化学の非常に重要な記事で異性体について解説したいと思います。
今回も頑張りましょう。
異性体とは・・・
異性体とは主に有機化合物で分子式が同じであるにも関わらず形が違うことによって性質が異なる化合物のことです。
前回の記事で有機化学では構成原子が4つと少ないながらも化合物の数が1億個を超えるという話をしましたが、原因は異性体が存在するせいです。
分子式が同じでも性質が異なる物は同じとせずに異なるもの(異性体)としたために化合物の数が莫大になったのです。
具体的にどういう性質が異なるかというと・・・
- 物性(物理的性質)・・・沸点/融点/密度/電気電導/熱伝導とか
- 反応性(化学的性質)・・・異性体によって反応性に違いが出る
異性体には様々な種類があって大きく以下のように分けれます。
- 異性体
- 構造異性体;原子の繋がり(枝分かれ)や不飽和度の違い
- 立体異性体;原子の繋がりや不飽和度は同じだが空間配置が異なる
これらについて個別に解説していきます。頑張りましょう。
構造異性体
構造異性体とは原子の繋がりや不飽和結合が違うことで性質が異なる化合物のことを言います。
構造異性体は2種類に分けることができます。
- 位置異性体・・・官能基の位置が違う
- 官能基異性体・・・官能基の種類が異なる
この2つに関して個別に解説します。
位置異性体について
位置異性体の例をいくつか示します。
例えば、以下のような官能基(例ではヒドロキシ基 -OH)の位置が違うことで性質が異なります(アルコールと言いますが、別の記事で解説)。
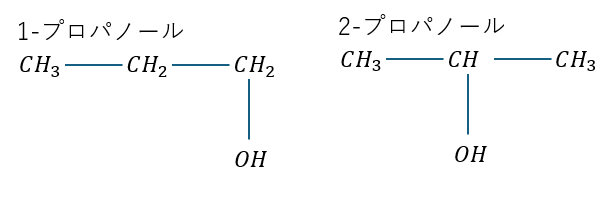
上に示した2つの物質で左側は一級アルコール、右側は二級アルコールと呼ばれていて反応性や物性が異なります。
また、以下に示す物質は炭素の骨格が違うので分子式が同じでも沸点や融点を初めとした物性が異なります。
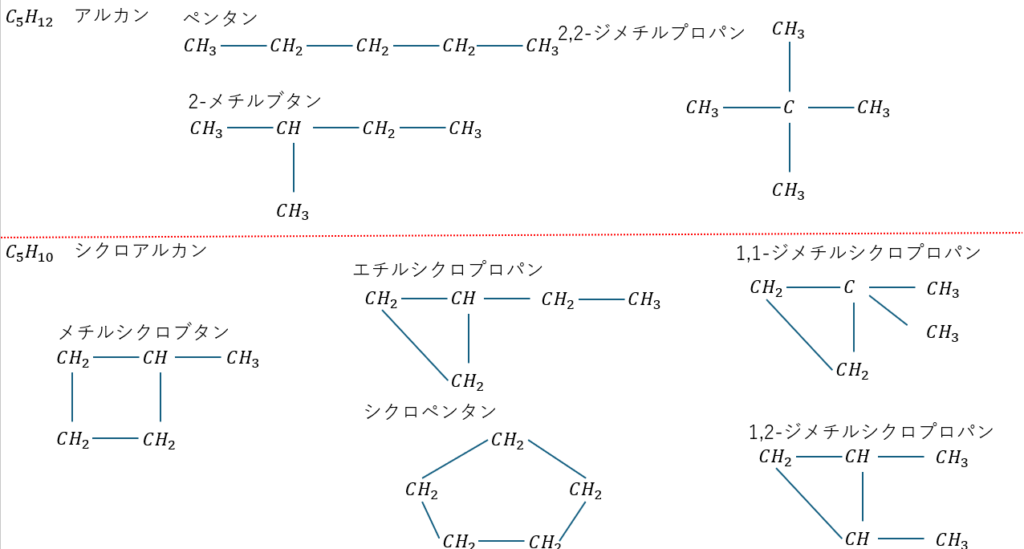
上に示すように炭素の繋がり(骨格)が違うことで様々な異性体が考えられます。
そして、芳香族化合物にも位置異性体があります。
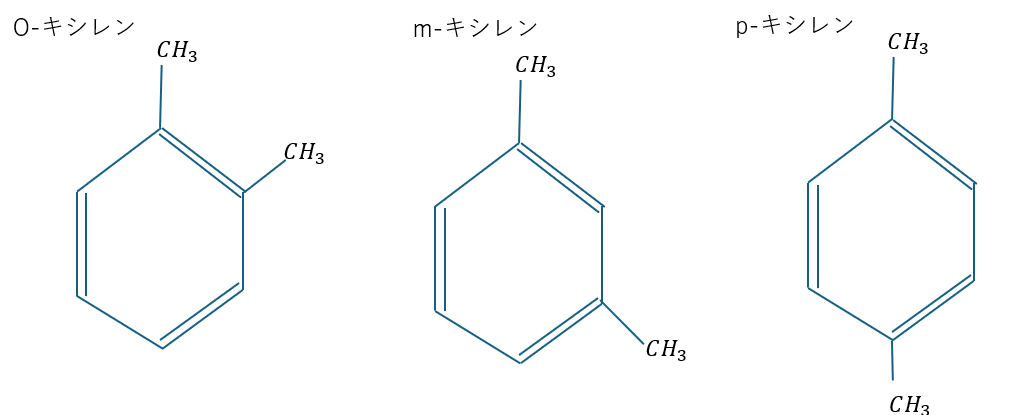
ベンゼン環に結合した2種類の置換基の位置によって異性体があって
- o(オルト)・・・角度が60°
- m(メタ)・・・角度が120°
- p(パラ)・・・角度が180°
官能基の種類や有機化合物の命名ルールは別の記事で解説します。
官能基異性体について
官能基異性体の例をいくつか紹介します。
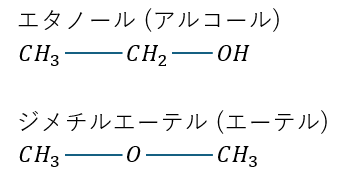
図に示す化合物は官能基がヒドロキシ基(-OH)とエーテル基(-O-)で異なります。
(上はアルコール/下はエーテル)
なので、分子式は同じですが、化学的性質や物性が全く異なる物質になります。
立体異性体
立体異性体とは原子の繋がり方(骨格)や不飽和結合の仕方は同じですが、空間的な配置が異なることでできる異性体のことです。
立体異性体は大きく2つに分けられます。
- 幾何異性体(シス=トランス異性体);二重結合が絡んだ対称性の違い
- 光学異性体;分子内に対称性を持たない (鏡の関係)
この2つに関して個別に解説します。
幾何異性体(シス=トランス異性体)
幾何異性体(シス=トランス異性体)は二重結合や三重結合が絡む異性体で、置換基の場所による異性体になります。
以下に幾何異性体の例を示します。
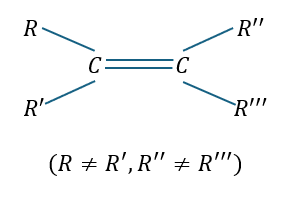
重要なのは置換基の条件です(ちなみに置換基は水素原子Hでもいい)。
- 縦方向・・・同じ物であってはならない
- 横方向・・・同じ物であっても良い (シス型)
- 対角線上・・・同じ物であっても良い (トランス型)
上の条件を満たした上で同じ原子や原子団(置換基)が1ペアでもあれば良いです。
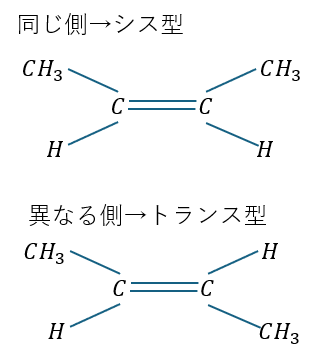
また、置換基が同じ側と異なる側で呼び方が異なっていて・・・
- 同じ置換基が同じ側・・・シス型
- 同じ置換基が異なる側(対角線上)・・・トランス側
具体例を以下に示します。
また、幾何異性体で性質が顕著に異なる例を示します。
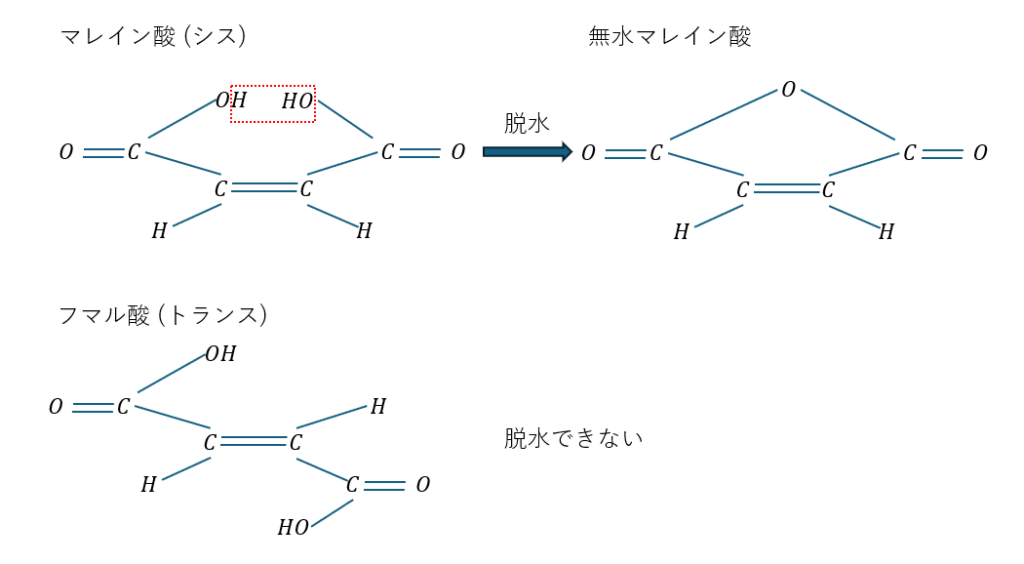
上のようにマレイン酸はシスとトランスで置換基の距離的な問題からシス型しか脱水しません。
また、極性の違いから沸点や融点も異なります(極性に対称性があるフマル酸の法が融点は高い)。
余談;幾何異性体ができる理由
ここからは発展的な内容になりますが、幾何異性体ができる理由を考えた事はありますでしょうか?
これは、何故、シス型とトランス型に分かれるかという疑問にぶち当たることになるのですが、これの根本原因は二重結合が自由に回転できないことにあると考えられます。
- 二重結合の原理
- σ結合(シグマ結合)・・・二重結合の一本目 (かなり硬い)
- π結合(パイ結合)・・・二重結合の二本目 (弱い)
σ結合が一本だけであれば自由に回転できますが、π結合が加わることで結合が非常に強固になり室温での自由回転を邪魔しているのです。
だから、幾何異性体は原子の位置が束縛されて関わる全ての原子が同一平面上に存在します(ねじれることがない)。
幾何異性体の難しい問題
以下のように二重結合が2つある場合は注意が必要です。
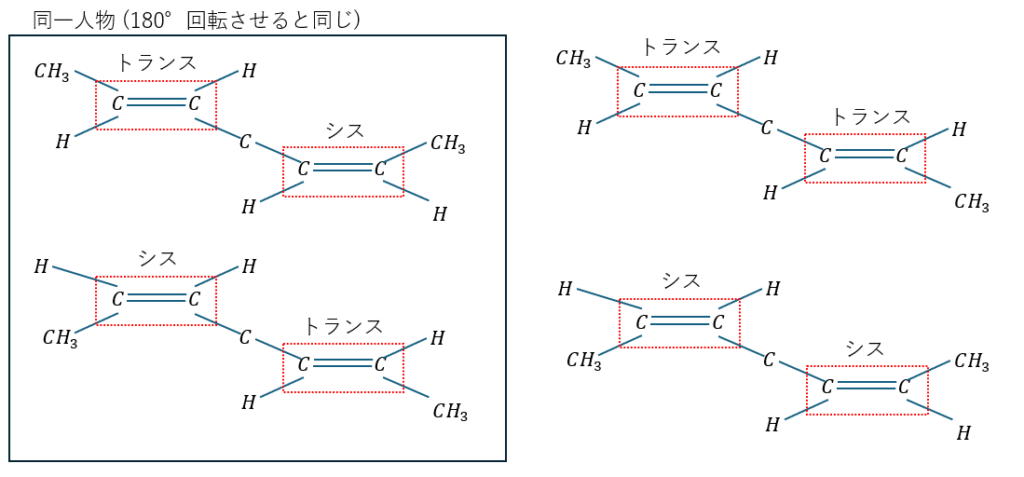
以上から幾何異性体は3種類になります。
実際に書いてみて回転させて一致するかどうかを考えてみてください。
光学異性体
光学異性体とは分子内に対称性を持たない(鏡の関係になっている)異性体のことです。
光学というと光に関係すると思いますが、実際に偏光と呼ばれる光を溶液に透過したときに偏光面が右か左のどちらかに回転するという性質を持ちます。
ちなみに、あくまで光学的性質が違うだけで物性や反応性は同じです。
光学異性体は正四面体構造のC原子へ結合する原子/原子団が全て異なることです。
この炭素原子のことを不斉炭素原子と言います。
以下に例を示します。
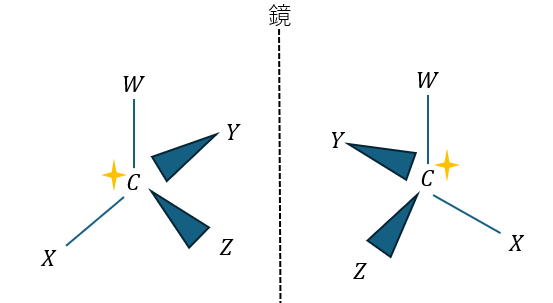
W,X,Y,Zは全て異なるのでCは不斉炭素原子です。ちなみに、構造式で不斉炭素原子を示すときは★か*をつけます。
上の図で実物と鏡像は互いに重なることは絶対にありません。
光学異性体のメソ体について
皆さんは不斉炭素原子があれば光学異性体があると考えていないでしょうか?
結論から言うとそれは間違いです。
不斉炭素原子が2以上で分子に対称性がある場合に限り光学異性体はありません。これをメソ体と言います。
メソ体の例を以下に示します。
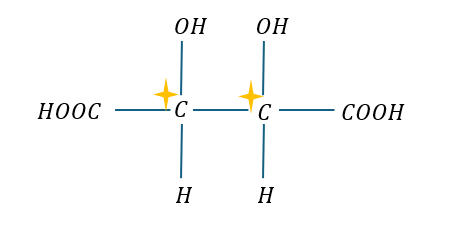
上に示す化合物は不斉炭素原子が2つで分子にも対称性があります。よって光学異性体はありません。
メソ体は難関大学であれば出てくる可能性は十分にありますので頭に入れておいてください。
光学異性体の難しい問題
不斉炭素原子が2つある場合には注意が必要です。
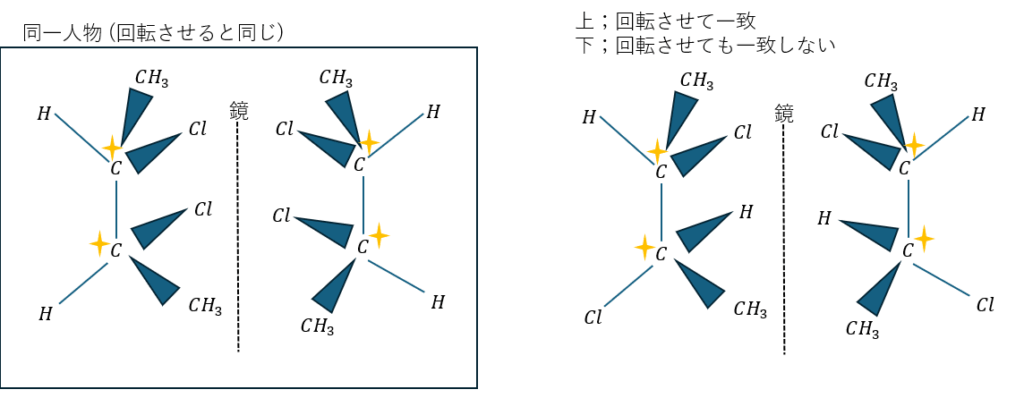
以上から光学異性体の数は3種類になります。
実際に光学異性体を書いて回転させて考えてみてください。
まとめ
最後に強の内容のまとめになります。以下の図をご覧ください。
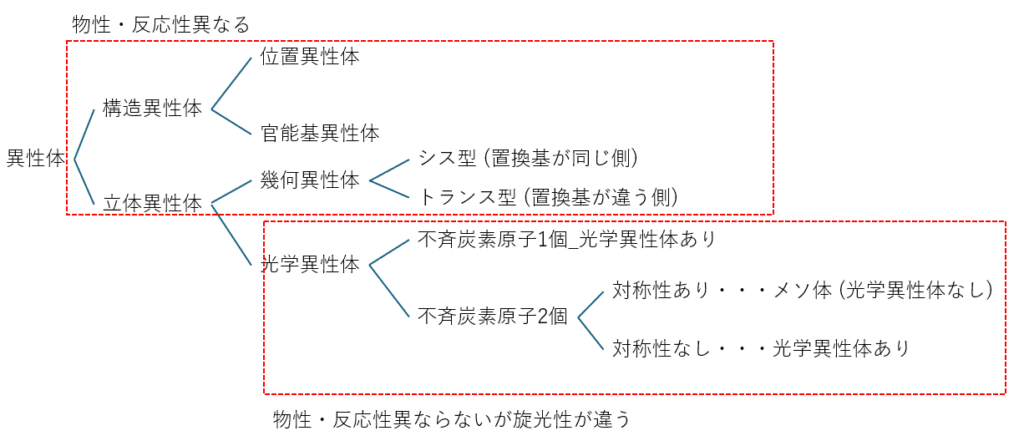
大変かもしれませんが頑張りましょう。



コメント