こんにちは。Horyです。
今回の記事ではグループ別・元素別各論で硫黄の同素体とその化合物に関して簡単に解説します。
硫黄は様々な酸化数を取ることで有名で以下の物質は酸化剤としても還元剤としても働くことが知られています。
- 二酸化硫黄;SO2
また、硫黄が成分になっている硫酸の製法である接触法も非常に重要です。
今回も頑張りましょう。
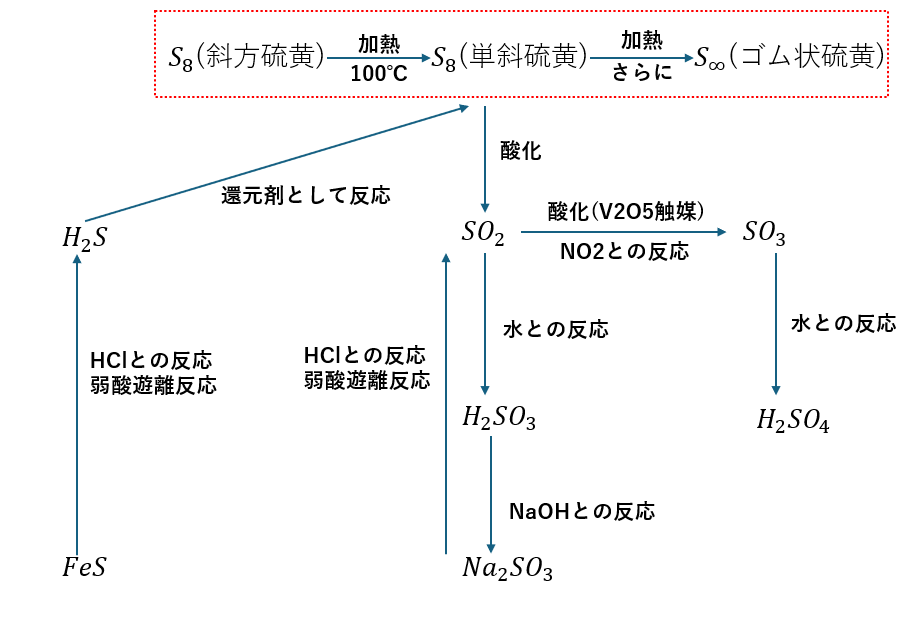
硫黄の同素体について・・・
硫黄の同素体に関しては種類が3つあります。
- 斜方硫黄・・・常温の状態_S8分子_針状
- 単斜硫黄・・・100℃の状態_S8分子_直方体
- ゴム状硫黄・・・さらに加熱_結合が切れる_無定型
これらに関してはネットで調べてみてください。形も自分で見て覚えた方が良いと思います。
硫黄の化合物について・・・
覚えておくべき硫黄の化合物は以下に示すとおりです。
- 硫化水素(H2S)
- 二酸化硫黄(SO2)
- 硫酸(H2SO4)
硫化水素について・・・
硫化水素の化学式はH2Sで表される気体です。
硫化水素は毒性が非常に強く、腐卵臭がする気体です。作り方としては硫化鉄に希塩酸や希硫酸を加えて生成します(中学の理科の実験)
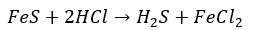
また、還元剤として働くことが知られていて半反応式は以下の通りです。上の反応は弱酸遊離反応でもあります。
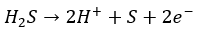
また、還元剤の硫化水素と酸化剤の二酸化硫黄が反応すると硫黄が分離して精製します。
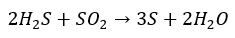
上の反応式も覚えておくと良いです。
二酸化硫黄について・・・
二酸化硫黄は硫黄の酸化物です。
酸化剤としても還元剤としても働き、刺激臭があることで知られています。
製法としては以下の化学式に示すとおりです。
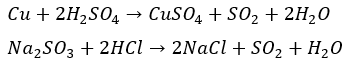
酸化剤や還元剤としての半反応式は以下に示すとおりです。
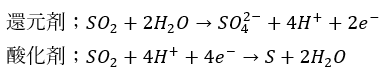
そして、皆さんは酸性雨という言葉を聞いたことがあるでしょうか?
窒素の酸化物も酸性雨の原因ですが、二酸化硫黄も酸性雨の原因です。反応は以下の通りです。
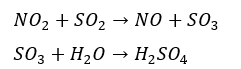
二酸化硫黄は水に溶けやすく、直接水と反応すると亜硫酸(H2SO3)になりますが、上の式のように二酸化窒素と反応してSO3となった後に水(大気中の水)と反応すると硫酸になります。
酸性雨の原因です。
硫酸と接触法
硫酸は非常に重要な化合物の1つです。
- 希硫酸・・・濃度が90%以下の硫酸→電離が進行する
- 濃硫酸・・・濃度が90%以上の硫酸→電離が進行しない・水素結合で不揮発
濃硫酸ついてはこちらの記事でも解説したので確認してみてください。
また、濃硫酸の乾燥剤に関する記事はこちらなので見といてください。
硫酸は接触法と呼ばれる方法で生成されていて、生成手順は以下の通りです。
- 硫酸は接触法と呼ばれる方法で生成されていて、生成手順は以下の通りです。
- 原油から硫黄を取りだす
- 硫黄を燃焼させて二酸化硫黄を生成
- 酸化バナジウム(V2O5)を触媒として二酸化硫黄を酸化して三酸化硫黄に
- 三酸化硫黄を水と反応させて硫酸の生成
ただ、上の方法で普通にやっても硫酸は採取できないので工夫します。
- 工夫①;硫酸の発熱で水が蒸発(溶液にならない)→濃硫酸にSO3の吸収→発煙硫酸
- 工夫②;発煙硫酸を希硫酸で希釈→濃硫酸へ
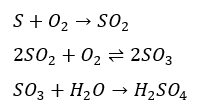
上に示したのが接触法と呼ばれる硫酸の工業的製法で接触法と呼ばれています。
一方で工業的出ない方法で過酸化水素に二酸化硫黄を反応させる方法でも硫酸は生成できます。
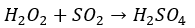
上の反応も覚えておくと良いです。
まとめ
硫黄とその化合物に関して簡単にまとめます。



コメント