こんにちは。Horyです。
前回の記事では金属イオンのイオン化傾向についてまとめました。
金属のイオン化傾向は後の系統分析で必ず使う分野なので、頭に入れておいてください。ただ、系統分析はイオン化傾向を覚えただけではできません。
沈殿が再溶解(再び溶ける)条件も頭に入れておかないとできないのです。
今回の記事では沈殿を再び溶かす条件について簡単にまとめます。
今回も頑張りましょう。
沈殿と溶解平衡について・・・
まずは、沈殿と溶解平衡について簡単にまとめます。
沈殿の溶解平衡とは、以下の二つの反応速度が等しく、水溶液中で変化が起こっていないように見える現象のことです。
- 沈殿がイオンになる勢い
- 陽イオンと陰イオンが合体して沈殿になる勢い
これを化学反応式で表すと(XYが沈殿とします)・・・
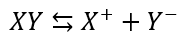
沈殿の再溶解について・・・
まずは、前回の記事で解説したイオン化傾向を図に示します。

沈殿が水溶液に再び溶ける原因で覚えておくべきなのは以下の5つです。
- 借イオンが絡む_液性が変化する
- 温度の上昇
- 中和による変化
- 分子の縮合による変化
- 酸化による変化
この5つに関して個別に紹介します。
借イオンが絡む_液性の変化
前回の金属の陽イオンと借イオンの紹介記事にて、
金属の陽イオンは水溶液中にて水和状態で存在していますが、水よりも安定な配位子が登場すると優先的にそれと結合するという話をしました。
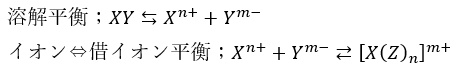
溶解平衡で「イオンが沈殿に戻る勢い」よりも「イオンが借イオンに変化する勢い」が大きければ沈殿は再溶解するのではないでしょうか?
前回の借イオンの記事でそれぞれの元素がどんな配位子と結合したかを思い出してください。
重要なのは以下の3つです。
- イオンがヒドロキシ基(OH)と優先的に結合
- イオンがアンモニア基(NH3)と優先的に結合
- イオンがチオ硫酸イオンと優先的に結合
基本的に上の3つを覚えれば大丈夫です。個別に紹介します。
ヒドロキシ基と優先的に結合
これは、水酸化ナトリウムを過剰に投入して溶液の液性を強塩基状態にした時を考えればいいです。
元素としてはAl(アルミニウム)、Zn(亜鉛)、Sn(スズ)、Pb(鉛)、Cr(クロム_3価)とかが当てはまります。
ただ、注意してほしいのが、水酸化ナトリウムを少量加えても水酸化物として沈殿するだけです。
「過剰に加える」というところが重要で、過剰に加えると借イオンになって溶けるのです。
イオンがアンモニア基と優先的に結合
これは、アンモニアを過剰に投入して溶液の液性を弱塩基状態にした時を考えるといいです。
元素としては、Zn(亜鉛)、Ni(ニッケル)、Co(コバルト)、Cu(銅_2価)、Ag(銀)を頭に入れておけばいいです。
亜鉛は、強塩基でもアンモニアでも溶けると覚えておきましょう。
チオ硫酸イオンと優先的に結合
これは、硫酸などを過剰に投入して溶液の液性を酸性状態にした時を考えるといいです。
元素としてはAg(銀)のみです。
なので、沈殿の再溶解でチオ硫酸イオンが出たときは条件反射で銀と覚えましょう。
ちなみに、銀に関する小話でハロゲン化銀というのがあって・・・
- AgCl・・・塩化銀(白)
- AgBr・・・臭化銀(淡黄色)
- AgI・・・ヨウ化銀(黄色)
ハロゲン化銀はハロゲンの原子番号が増えるほど水に溶けにくいです。ただ、チオ硫酸イオンを過剰投下すると全て溶けます。
温度の上昇
温度の上昇によって沈殿が溶ける場合があります。
これは条件反射で塩化鉛(PbCl2)と覚えればいいです。熱湯を投下することで再び溶けます。
ちなみに、ここに、クロム酸イオンを加えるとPbCrO4の黄色沈殿ができます。
これも覚えておくといいです。
ちなみに、余談ですが・・・
- BaCrO4・・・クロム酸バリウム (黄色沈殿)
- PbCrO4・・・クロム酸鉛 (黄色沈殿)
- Ag2CrO4・・・クロム酸銀 (赤褐色沈殿)
クロム酸とバリウム・鉛・銀の沈殿も色と共に頭に入れといたほうがいいです。
中和による変化
中和による変化についてです。
これは、水酸化鉄 (2価・3価ともに)の変化を考えればいいです。
基本的に以下のステップで覚えます。
- 水酸化鉄(沈殿)の存在する水溶液
- 塩酸の投下 (中和)
- 塩化鉄となって溶解
- 借塩K3[Fe(CN)6]⇔Fe(OH)2、K4[Fe(CN)6] ⇔Fe(OH)3の投下→濃青沈殿
ヘキサシアン鉄イオンを加えて濃青沈殿ができるところまでセットで覚えてください
ちなみに、水酸化鉄の沈殿の色も含めて覚えといてくださいね。
分子の縮合による変化
分子の縮合によって分子構造が変化することで溶けやすい構造になって再溶解するというプロセスです。
これは「クロム酸イオン⇔ニクロム酸イオン」の変化と考えればいいです。
強酸性のクロム酸イオンの水溶液に硝酸を加えると・・・
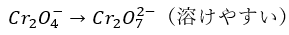
酸化による変化
イオン化傾向で硫化物の沈殿について話したときに、こんなことを言ったのを覚えているでしょうか・・・
- グループ③以降の硫化物沈殿について・・・
- Mn~Ni・・・強酸性で溶解
- Sn以降・・・沈殿する
つまり、Sn(スズ)以降の硫化物は溶液の液性に関わらずに沈殿します。
これを溶けるようにするためには硝酸(HNO3)を加えます。
原理としては・・・
- 硫化物の沈殿が水溶液に存在
- 硝酸が沈殿の硫黄から電子を奪う (酸化剤としての働き)
- 硫黄がイオンじゃなくなる
- 沈殿の構造が崩れて水に溶解する
硫化物沈殿の小話
グループ③以降の硫化物沈殿について・・・
- Mn~Ni・・・強酸性で溶解
- Sn以降・・・液性に関わらず沈殿する
何でこうなるか疑問に思いませんか?
水溶液中では化学平衡が3つ起こっています。
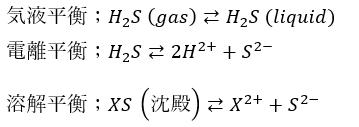
ここで、重要なのは電離平衡と溶解平衡の関係です。
化学平衡のルシャトリエの原理を思い出してください。
溶液が酸性や塩基性になるときに平衡はどちらに傾くでしょうか?
ちょっと考えてみてください。
ヒントは酸性や塩基性で電離平衡がどちらに傾いて、その結果として溶解平衡がどちらに傾くかを考えてみてください。
ここまで記事をちゃんと読んできた君ならできる!

コメント