こんにちは。Horyです。
酸と塩基を投入すると中和反応が起きて塩が生成します。
今回の記事で解説することは以下の3つです。
- 塩の加水分解について
- 塩の水溶液の液性
- 塩の種類
今回の内容は非常に厄介な分野になっていますので頑張りましょう。
塩とは何か・・・
塩とは「酸と塩基の中和により生成される物質」のことです。
- 中和
- 酸+塩基→塩+水
このように考えても良いかもしれませんが・・・
もっと詳しく説明すると「塩とは酸性由来の陰イオンと塩基性由来の陽イオンが化合した物質」と言うこともできます。
例えば、塩酸と水酸化ナトリウムについて考えると・・・
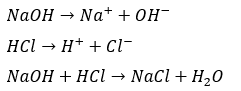
確かに、酸の塩素イオンと塩基のナトリウムイオンで塩化ナトリウム(塩)ができていますね。
塩の水溶液の液性
塩の水溶液の液性について議論します。以下の順番で解説します。
- 塩の加水分解
- 問答無用で酸性になる場合 (覚える必要あり)
- 強酸と強塩基の塩
- 弱酸と強塩基の塩
- 強酸と弱塩基の塩
これらについて順番に解説します。
「塩の加水分解」という見慣れない言葉が出てきましたが、これを理解しなければ液性を判断できないので頑張りましょう。
塩の加水分解
塩の加水分解とは、「弱酸と強塩基」・「強酸と弱塩基」の中和反応で生成される塩が水と反応することです。
まぁ、例を示した方が早いので以下の例を個別にまとめます。
弱酸と強塩基 (酢酸+水酸化ナトリウム)
弱酸と強塩基の反応です。
中和の化学反応式と水溶液中で何が起きているかを分けて記述します。

- 酢酸は電離が可逆反応
- 水溶液中に酢酸と酢酸イオンの両方が存在
- 酢酸イオンが水と反応 →酢酸と水酸化物イオンが生成
- 水酸化物イオンの生成で塩基性に
ここで、注意しなければならないことが、加水分解はほとんど起きていないです。
そのため、理論化学における電離平衡の計算では加水分解の物質量は無視します。
しかし、pHは無視できないので「弱酸と強塩基の加水分解」の水溶液は塩基性になります。
また、水溶液中の反応なので水は多量にあります。
中和で生成される水だけが使用されているわけではないです。
また、多くの受験生が勘違いするのが「中和で生成される酢酸ナトリウムはどこに行ってしまったのか?」という疑問です。
これについてですが、「水溶液中の反応」と言うことを忘れないでください。例を出すと、塩化ナトリウムを水に投入するとイオンに分離します。これと同じです。
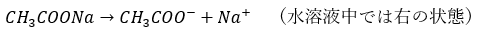
この反応は多量の水がある水溶液中で起きているため、右の状態で常に存在しています。
中和反応で書くと「水溶液中でも酢酸ナトリウムは存在する」というような錯覚を与えてしまいますが、水溶液中ではイオンとして存在します。
強酸と弱塩基 (塩酸とアンモニア)
最初に断っておきますが、この反応における酸と塩基の定義はブレンステッドとローリーの定義になります。
中和の化学反応式と水溶液中で何が起きているかを分けて記述します。

今回の酸と塩基の定義がブレンステッドとローリーの定義であることに注意すると・・・
- アンモニアは弱塩基なので可逆反応
- 水溶液中にアンモニウムイオンとアンモニアが両方存在
- アンモニウムイオンが水と反応してオキソニウムイオン生成
- オキソニウムイオンが原因で酸性に
「強酸と弱塩基の加水分解」の水溶液は酸性になります。
また、水溶液中の反応なので水は多量にあります。
中和で生成される水だけが使用されているわけではないです。
ここでも、多くの受験生が勘違いするのが「中和で生成される塩化アンモニウムはどこに行ってしまったのか?」という疑問ですが、水溶液中の反応なので・・・
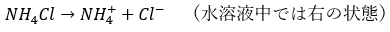
塩の加水分解と水溶液の液性
塩の加水分解と水溶液の液性についてまとめます。酢酸とアンモニアの反応を用いてまとめます。
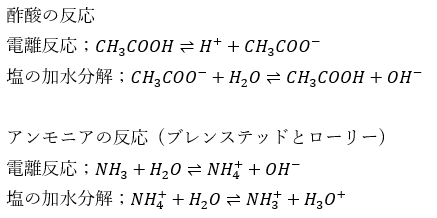
つまり、塩の水溶液の液性は以下のことが重要なのではないでしょうか・・・
- 酸や塩基の電離が可逆 or 不可逆 (強酸・弱酸・強塩基・弱塩基)
- 電離が可逆だとして加水分解は?
- 加水分解と電離の勢いはどっちが早い?
問答無用で酸性になる場合 (覚える必要あり)
以下のイオンが含まれる塩の水溶液は問答無用で酸性になります。
- 硫酸水素イオン・・・HSO4^-
- 亜硫酸水素イオン・・・HSO3^-
- リン酸水素イオン・・・H2PO4^-
何故かというと、これらのイオンは硫酸やリン酸の電離によって生成されますが、電離定数がバカでかくほぼ確実に電離します(反応が不可逆)。
だから、加水分解など起こりえないのです。
強酸と強塩基の塩
強酸と強塩基の塩の水溶液は中性になります。
考えてみれば分かると思いますが、強酸と強塩基の電離は不可逆です。
だから、加水分解など起こりません。
例えば、塩化ナトリウムを水に投入するとイオンとして存在しますが・・・
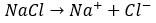
これらのイオンは水とは反応しないので水素イオンも水酸化物イオンも放出しません。当然、溶液の液性は中性になります。
弱酸と強塩基の塩
弱酸と強塩基の塩の水溶液は加水分解の勢いが電離の勢いよりも強いので塩基性になります。
「炭酸;CO3^2-」等が出てきたら注意が必要です。
実際に例を示します。
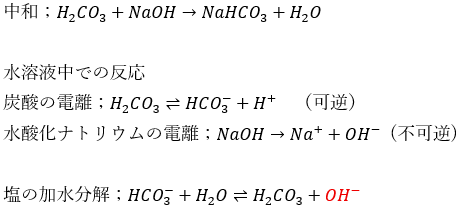
加水分解の勢いが強いので塩基性になります。
強酸と弱塩基の塩
先ほどの説明の通り、加水分解の勢いが強いでの強酸と弱塩基の塩の水溶液は酸性になります。

塩の種類について・・・
塩の種類について解説します。
分け方は大きく2つです。
- 塩に含まれるイオンの種類によって分類する
- 塩に含まれるイオンの数などで分類する
これら2つについて個別に解説します。
塩に含まれるイオンの種類で分類
分け方は以下の3つです。
- 中性塩・・・塩に水素イオンや水酸化イオンを含まない
- 酸性塩・・・塩に水素イオンを含む
- 塩基性塩・・・塩に水酸化物イオンを含む
ここで、絶対にやってほしくないのは「酸性塩の水溶液は酸性」「塩基性塩の水溶液は塩基性」のように判断しないでください。
塩の名称と水溶液の液性は必ずしも一致しません。

酸性塩ですが、水溶液の液性は塩基性!
塩に含まれるイオンの数などで分類
塩に含まれるイオンの数などで分類する方法です。
分け方は3つあります。
- 単塩・・・1種類ずつの陽イオンと陰イオン
- 複塩・・・2種以上の陽イオンと陰イオン
- 借塩・・・借イオンを含む塩
借イオンについては別の記事で解説します。
まとめ
最後にまとめです。
今回の記事の内容は非常にヘビーだったと思いますが、以下のことを理解していただきたいです。
- 加水分解とは何か
- 電離と加水分解の違い
- 電離や加水分解は水溶液中での反応
- 水溶液中で塩はイオンとして存在
- 塩の水溶液の液性と加水分解について
- 塩の種類
特に加水分解は非常に大切です。
多くの高校生は何が起きているか分からずに頭を抱えている様子を何度も見たので、頑張ってください。
また、塩の水溶液の液性は最悪、暗記してしまっても良いですが、考え方を理解してほしいのと、加水分解については必ず原理を理解してください
正直、この記事は加水分解の理解がメインになっています(笑)。


コメント