こんにちは。Horyです。
前回の記事では酸性物質と塩基性物質についてまとめると共に、それらの判定方法について簡単に解説しました。
ところで、酸性物質について酸性の強さの度合いがありますが、これを理解するためには酸化と還元について理解していないといけません。
今回の記事でまとめることは以下に示すとおりです。
- 酸化と還元の定義の歴史
- 酸化数のルール
- 酸化剤と還元剤について
これら3点について話していこうと思います。
今回の記事も重要記事になりますので頑張ってください。
酸化と還元の定義の歴史
酸化と還元の定義の歴史は以下のように変遷していきました。
- 酸素の動きに着目した定義・・・古い
- 水素の動きに着目した定義・・・有機化学はこれで考えて差し支えない
- 電子の動きに着目した定義・・・これが現在の主流
- 酸化剤や還元剤に着目した定義・・・電子による定義の拡張
これらについて個別に解説します。
酸素の動きに着目した定義
酸素の動きに注目した定義です。正直、酸化・還元の分野が開拓されたばかりの定義になるので非常に古いです。
この定義が通用するのは中学の理科までで、高校の化学では通用しないと思ってください。
- 酸化・・・物質が酸素と化合 (その物質は酸化された)
- 還元・・・物質が酸素を失う (その物質は還元された)
中学校の理科で銅の燃焼実験を行って酸化銅(黒色)を作った思いますが・・・

水素の動きに着目した定義
次に水素の動きに着目した定義です。
有機化学では酸化・還元を水素の動きに注目して定義しても差し支えないです。
- 酸化・・・物質が水素を失う反応 (その物質は酸化された)
- 還元・・・物質が水素と化合する反応 (その物質は還元された)

電子の動きに着目した定義
電子の動きに着目した定義です。
これは、現在の酸化・還元の定義の主流になっているのでこちらで考えた方が良いです。
- 酸化・・・物質が電子を失う反応
- 還元・・・物質が電子を得る反応
電子のやりとりが関与するなら電気陰性度が重要になります。
電気陰性度とは「俺の電子は俺のもの、お前の電子は俺のもの」というジャイアニズムの強さを数値化したモノです。
だから、化学反応で電気陰性度の大小が分かっていればある程度は何が酸化されて何が還元されたか分かるはずです。
水の反応を考えてみます。
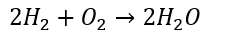
- 水素・・・のび太 (電気陰性度2.1=基準)
- 酸素・・・ジャイアン (電気陰性度3.5)
- 水素は酸素に電子を奪われて酸素は電子を得る
- 水素・・・酸化される
- 酸素・・・還元される
この電気陰性度(ジャイアニズム)による電子の酸化・還元の定義は最後の方まで使えるので必ず頭に入れておいてください。
酸化剤と還元剤による定義
酸化剤と還元剤による定義になります。
これは、電子の動きに注目した定義をさらに拡張したモノです。
- 酸化剤について・・・
- 相手を酸化させる = 相手の電子を奪う (ジャイアニズム大)
- 自分は電子を得る = 自分は反応して還元される
- 還元剤について・・・
- 相手を還元させる = 相手から電子を奪われる (ジャイアニズム小)
- 自分は電子を失う = 自分は酸化される
この説明をまとめると、電子は「還元剤から酸化剤へと移動する」これが重要です。
つまり、「電子はジャイアニズム(電気陰性度)が低い物質からジャイアニズムが高い物質へ移動する」このことを頭に入れといてください。
酸化数のルール
酸化数について簡単に解説します。これも多くの受験生を苦しめる要因になっています。
そもそも、なんでこんなものが導入されているかと言うと・・・
酸化・還元では「電子をどれだけ相手から奪った?」「自分の電子をどれだけ奪われた?」が大切になります。
これを明確にするために酸化数と言うモノが使われます。
ちなみに、共有結合中の電子の所有権は電気陰性度の大きいモノが優先されます。また、電気陰性度が出てきました。
結局はこれもジャイアニズムに帰着できます。
- 酸化数について・・・
- 電子を得る・・・負の値に (最外殻の空いている所に電子が全部入る・・・最低酸化数)
- 電子を失う・・・正の値に (最外殻の電子を全て失う・・・最高酸化数)
- 酸化数のルール・・・
- 単体の酸化数は「0」と約束する
- 単原子イオンならイオンの価数を酸化数と約束する
- ハロゲンのイオンは一般的に「-1」
- 酸素イオンは一般的に「-2」・ただし、過酸化水素の酸素は「-1」
- 水素は金属と化合して「-1」・それ以外なら一般的に「+1」
このようなルールがありますが、電気陰性度で考えてみてください。あっという間です。
- 無機化学の電気陰性度
- F (フッ素)・・・ジャイアンのママ (電気陰性度4.0・・・最大)
- O (酸素)・・・ジャイアン (電気陰性度3.5)
- Cl (塩素)・・・ドラえもん (電気陰性度 3.2)
- N (窒素)・・・しずかちゃん (電気陰性度 3.0)
- C (炭素)・・・スネ夫 (電気陰性度 2.5)
- H (水素)・・・のび太 (電気陰性度2.1 基準)
- 金属元素・・・のび太より弱い (電気陰性度2.1以下)
何で、水素は金属と化合して酸化数が「-1」になるのかというと、金属元素は電気陰性度(ジャイアニズム)が水素(のび太)よりも弱く、のび太にすら電子を奪われるからです。
金属と化合して水素は電子を奪うので酸化数が「-1」になります。
酸化還元反応かどうかの判定
酸化還元反応が起きているかどうかの判定についてです。
ちなみに、化学反応で「酸化だけ」or「還元だけ」が起こることはあり得ません。
先ほども言いましたが、酸化・還元は電子を奪う・奪われるナノで・・・
「電子を奪ったやつがいれば必ず奪われたやつがいます」。
要するに「ジャイアニズムの首謀者とジャイアニズムの被害者は必ずいる」ということです。
- 酸化還元反応ではない
- 反応の前後で全原子の酸化数に変化がない
- 例1;沈殿の生成反応
- 例2;金属単体なしの借イオン形成反応
- 例3;中和反応
- 例4;弱酸・弱塩基遊離反応
- 例5;揮発性酸の反応
- 酸化還元反応である
- 反応の前後で一部原子の酸化数が変化する
酸化剤か還元剤かの判定
酸化剤か還元剤かの判定についてですが、明確な判定方法はありません。
しかし、電気陰性度(ジャイアニズム)に注目すれば比較的にやりやすいです。
- 還元剤 (相手を還元⇔自分は酸化)・・・自分は電子を失う
- 電気陰性度(ジャイアニズム)が比較的低い元素とか・・・
- 金属
- 水素 (H2)
- シュウ酸(H2C2O4)のシュウ酸イオン (C2O4^2-)
- チオ硫酸イオン (S2O3^2-)
- 酸化剤 (相手を酸化⇔自分は還元)・・・自分は電子を得る
- 電気陰性度(ジャイアニズム)が比較的高い元素とか・・・
- 酸素 (ジャイアン)
- オゾン
- ハロゲン
- 過マンガン酸イオン (MnO4^-)
- 二クロム酸イオン (Cr2O7^2-)
- 酸化剤にも還元剤にも慣れる
- 過酸化水素 (H2O2)
- 二酸化硫黄 (SO2)
- 上の2つは覚えた方が良い
コメント