こんにちは。Horyです。
前回の記事では反応速度について、アレニウスの式を示すと共に問題を解説しました。
今回の記事では、化学反応における化学平衡に関して原理と本質から説明します。
ちなみに、反応速度について理解していないとこの記事の内容は理解できないので前回の記事は必ず読んでおいてください。
今回も頑張りましょう。
可逆反応と不可逆反応
平衡について解説する前に、可逆反応と不可逆反応については解説しないといけません。
ところで、皆さんは、化学反応式を書くときに「wA+xB→yC+zD」のように書くと思いますが、
「x [mol]のAとy [mol]のBを入れると、AとBは全てなくなってCになる」と思いますか?
答えは、「反応による」というのが答えです。
どういうことかと言うと・・・
- 「wA+xB→yC+zD」という反応・・・正反応
- 「wA+xB←yC+zD」という反応・・・逆反応
- 2つの反応が同時に進んでいる
まとめると・・・
- 可逆反応 (可逆とは巻き戻せると言う意味)
- 「wA+xB→yC+zD」という反応・・・正反応
- 「wA+xB→yC+zD」という反応・・・逆反応
- 2つ合わせて「wA+xB⇌yC+zD」と書く・・・可逆反応
- 100%反応が進むことはない
- 不可逆反応 (不可逆とは巻き戻せないと言う意味)
- 「wA+xB→yC+zD」と書く
- 100%進む
可逆反応の場合には平衡定数というモノがあって、これをKと表すと以下のように立式できます(ただし、[ ]は濃度[mol/L]とします)。
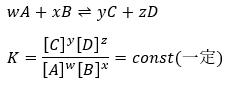
化学平衡の原理
化学平衡とは「正反応と逆反応の反応速度が等しくなることで、反応が止まっているように見える」ことです。
「止まっているように見える」だけで「止まっているわけではない」ことに注意してください。
例えば、「wA+xB⇌yC+zD」反応が平衡状態のとき、先ほど示した以下の式が成立します。
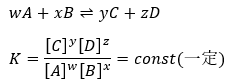
これだけだとちょっと分かりにくいと思うので、反応速度と絡めた説明を行います。
次のような反応を考えて正反応と逆反応の反応速度を以下のように定義します。

それぞれの物質の濃度と反応速度のグラフを示します。
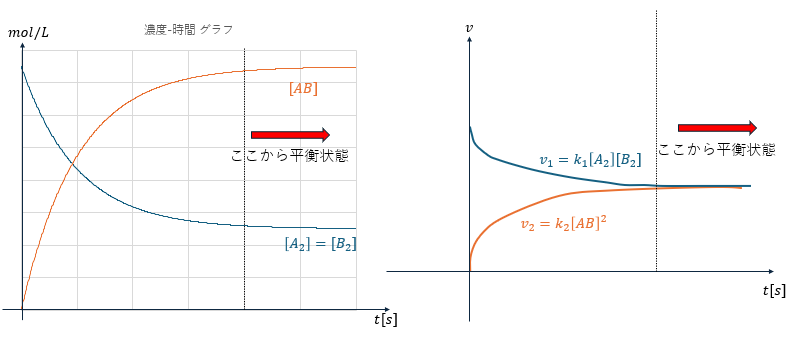
正反応と逆反応の反応速度が同じになるのが平衡の条件なので・・・
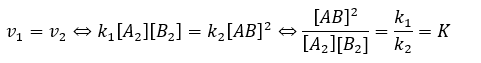
このようにして平衡定数を求めます。
平衡定数は温度に依存する定数です。そのため、温度が変わらなければ変化することはありません。
化学平衡の注意点
化学平衡の注意点について簡単にまとめます。
- 固体が化学反応式にある
- 水溶液中の水が反応に関与
主にこの2つに関しては注意が必要です。これらについて個別に解説します。
化学反応式に固体
固体が化学反応式にあるときですが、固体はモル濃度を一定と見なします。
例えば、以下のような化学反応式の平衡定数を求めるとすると・・・
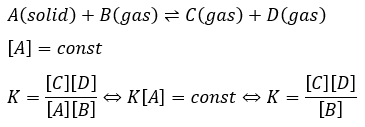
このように、固体については化学反応式に出てきても平衡定数については考えなくても大丈夫です。
水溶液中の水が反応に関与
水溶液中の水が反応に関与する場合を考えます。
まずは、水が1Lある場合の水のモル濃度を求めてみます。
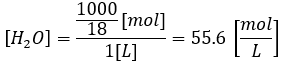
水溶液中の水のモル濃度は常に55.6です(これは覚えても良い)。この55.6と言う値はモル濃度としては極めて高い値です。
だから、「普通の」反応では「水溶液中」の化学反応で水が使用されたとしても水のモル濃度は変化しないとみて良いです。
よって、水のモル濃度は省いても良いです。
水溶液中での以下に示す化学反応の平衡定数を求めてみます。

以上から、水溶液中で水が反応するとき、平衡定数に水のモル濃度は考慮しなくても良いです。
ところで、先の説明で「普通の」反応では「水溶液中」の化学反応で水が使用されたとしても水のモル濃度は変化しないとみて良いと言いましたが、「普通じゃない反応」もあります。
それは、水溶液中の水の濃度が大きく変化する反応などデス。
そのような場合は水のモル濃度に関しても無視することはできません。


コメント