こんにちは。Horyです。
これまでに化学反応について学んだと思いますが、化学反応にも速度があることは知っていますか?
今回の記事では化学反応における反応速度について簡単に解説するとともに、反応を速くする方法をまとめました。
今回も頑張りましょう。
化学反応と反応速度
化学反応の反応速度とは、微小時間当たりの生成物や反応物の濃度変化を微小時間で割った値です。
例えば、「A+B→C」の反応で反応物AとCの濃度変化について横軸を時間として図に表してみます。
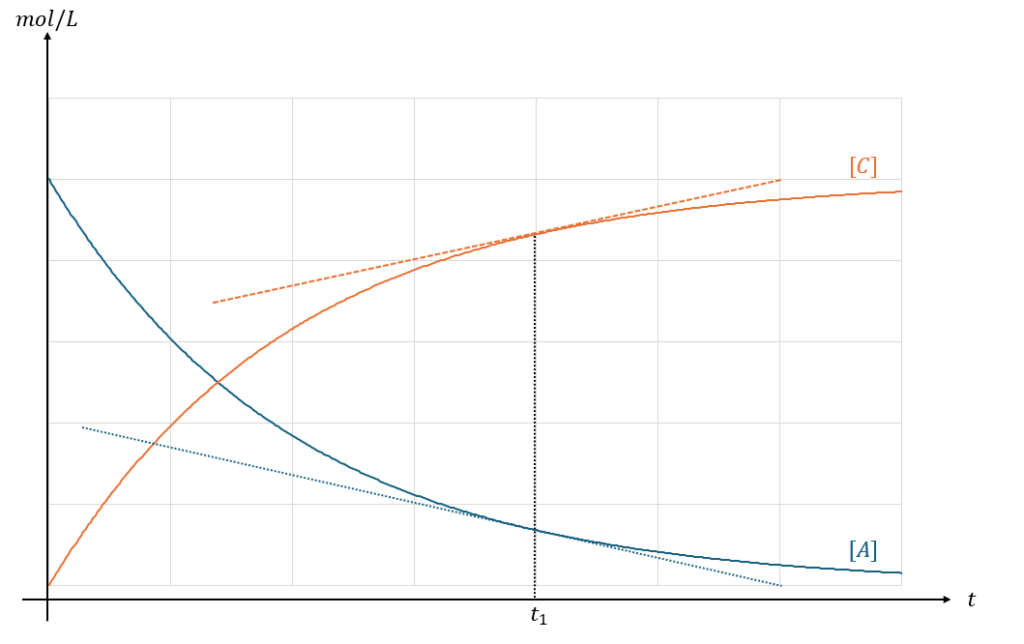
ここで、化学における反応速度の定義を考えると・・・

のように書けます(上の式はXの濃度変化)。
物理の記事になりますが、以下の式に速度についてもう少し詳しい説明がされているので気になる人は見てみてください。
まとめると、t1での反応速度を求めたいのであれば、t1での接線の傾きの大きさを求めればいいだけです。
- 図のオレンジの点線の傾きの大きさが時刻t1におけるCの生成速度
- 図の青の点線の傾きの大きさが時刻t1におけるAの減少速度
ちなみに、化学において反応速度は問題文で基本的に「速さ」を表します。「速さ」なので絶対値です。
- 濃度が減少している・・・反応速度にマイナスをつける
- 濃度が増加している・・・なにもしなくていい

先ほど、接線の傾きといいましたが、これをやってしまうと数学になります。なので、化学の問題では平均の速度というもので反応速度が出てきます。
どういうことかというと・・・
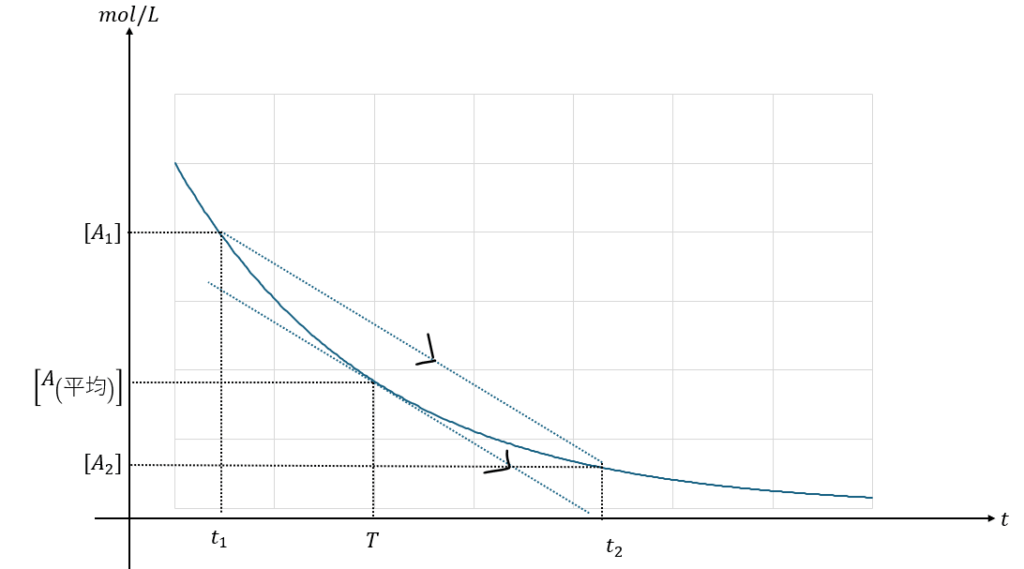
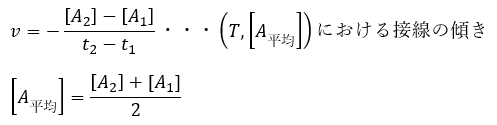
ここで、t1での瞬間の反応速度を考えるのであれば、t2を右側からt1に近づけていけばいいですね。
これ以上は数学になってしまうのでやめておきますが、微分の定義とは接線を求めることです。
ちなみに、減少速度や生成速度は化学反応式の係数に比例します。
例えば・・・XとYは係数(自然数)であるとして・・・
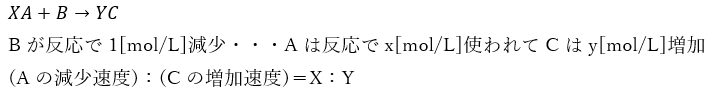
化学反応と活性化
化学反応がどのように起こっているか説明できますか?
化学反応が原子の組み換えということは話しましたが、反応のプロセスまでは詳しく話していないと思います。
この節ではそれを紹介します。
化学反応とは以下のプロセスで起こります。
- 異なる分子同士が衝突 (接触)
- 接触後に同じ原子同士の結合エネルギーを切って別の原子同士で結合
- 生成物が安定化→熱を外に放出
これについて、分子X2とY2が反応し、2XYが生成する反応でエネルギー図を書いてみます。
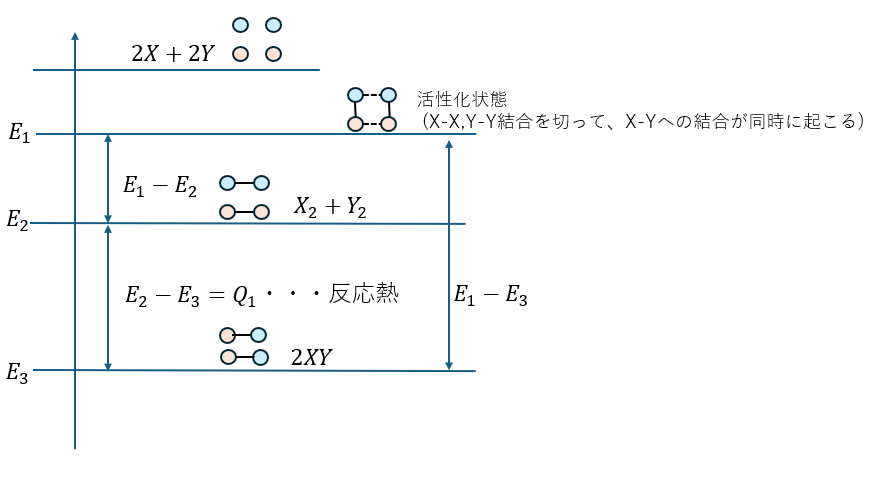
この図で大切なことは、化学反応で原子を組み替えて化合物を作るためには必ず活性化状態というエネルギー序列に行かないと反応できないということです。
図中における活性化状態とは・・・
- 同種原子同士の結合を断ち切る (図中の点線)
- 異種原子同士で結合する (図中の実線)
- これが同時に起こるエネルギー序列 (このように考えてください)
- 注意;全部がバラバラになってるわけでない
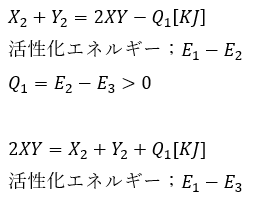
このように反応の方向(正反応か逆反応)かで活性化エネルギーの大きさは変わってきます。
エネルギー図を書いてイメージできるようになってください。
反応速度を速くしたい
反応速度を上げるにはどうすればいいでしょうか?
3つの方法があります。
- 分子(原子)同士の衝突(接触)回数を増やすような細工をする
- 活性化エネルギーを小さくする
- 表面積を増やす
これら3つに関して個別に解説します。
ただし、簡易化のために、細工するパラメータ以外は一定とみなします。
接触回数を増やす
- 細工パラメータ;濃度を増加 (物質を密閉容器にいっぱい入れる)
- 濃度を増加させる
- 密閉容器における粒子密度の増加
- 接触頻度の増加
- 細工パラメータ;圧力の増加
- 圧力を増加させる
- 気体の分圧が増加するが、体積が減少
- 粒子密度の増加
- 接触頻度の増加
- 細工パラメータ;温度の増加
- 温度を高温に
- 粒子の熱運動が激しくなる
- 粒子の速度が相対的に増加
- 接触頻度の増加
活性化エネルギー減少
上の説明で化学反応が起きるには活性化状態にならないといけないと言いました。
活性化状態になるには活性化エネルギーが必要ですが、何らかの方法でこれを下げればいいという考え方です。
そのために投入するのが触媒というものです。
これは、触媒自身は反応を起こしませんが、環境を変えることで、活性化のハードルを下げるというものです。
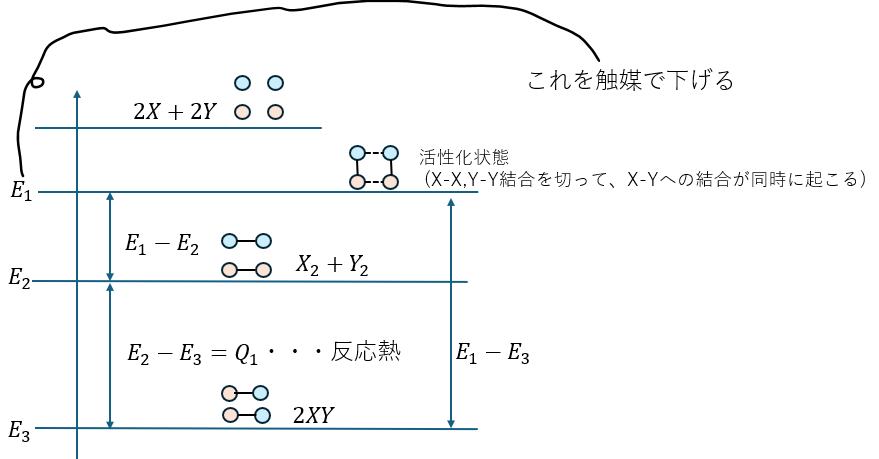
ちなみに、有機化学や生物では触媒のことを酵素と呼んだりもします。
表面積を増やす
- 細工パラメータ;表面積を増やす
- 物質を細かく砕く
- 物質の表面積が増える
- 粒子との接触面積が増える
- 接触頻度が増える (砕いていないと内部は接触してないことになる)
ちなみにですが、立体の体積は有限でも、無限に細かくすると表面積は無限大になります(数学的知識)。
これは、日常生活でも応用できることで・・・
- 鉄は空気と反応しない?
- 鉄を細かく砕く
- 鉄粉上にして空気上にばら撒く
- 火がついて燃える (金属を粉末にするのは非常に危ない)
- 粉塵爆発
- 粉塵は物質を極限まで細かくしたもの (表面積無限大)
- 空気との摩擦で発火 (ただし、乾燥した状態)
- 爆発する (実際に爆発する)
- (粉塵爆発もメカニズムは表面積にあると思う)



コメント