こんにちは。Horyです。
前回の記事では熱化学方程式について、新課程と旧課程の違いを解説するとともに基本的なことをまとめました。
今回の記事では、高校化学で目にすることになる様々な反応と熱化学方程式を絡めて紹介するとともに、この分野で知って押さえなければならないエネルギー図に関しても解説します。
念のためですが、温度や圧力等の条件は(25[℃]・1×10^5[Pa]とします。これを熱化学の標準状態といいます。)
今回も頑張りましょう。
反応熱やエネルギーの単位や定義
熱化学方程式では反応熱やエネルギー(結合エネルギー・格子エネルギー)も単位は[KJ/mol]です。
これが意味するところは1molで何KJの熱をやりとりするかです。
ここで、疑問になるのが「何が1molであるか?」ということです。これは、化学反応の種類によって異なりますが、基本的に・・・
- 反応後に生成する化合物が1mol
- 反応前の物質が1mol
以上の二つに分けられます。また、今回紹介する化学反応は以下の通りです。
- 化学反応に対する化学変化
- 物理変化に対する状態変化
- 原子や分子の結合
この3つにおける変化を個別に解説します。
化学反応に対する化学変化
化学変化に対する化学反応は以下に示す3つです。
- 酸素が絡む燃焼反応 (燃やす)
- 単体とかを結合させる生成反応
- 酸と塩基を反応させる中和反応
これらについて個別に解説します。
燃焼反応
燃焼反応についてです。これは、有機物や金属を酸素と反応させて燃焼させる反応を熱化学方程式に記述したものです。
プロパン(C3H8)を酸素と燃焼させる反応を考えてみます。
この場合は反応前のプロパンを1molとして熱化学方程式を考えます。
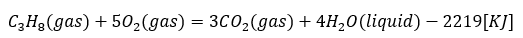
- 式の左辺・・・プロパンと酸素を反応 (燃やす)
- 式の右辺・・・二酸化炭素と水の生成
- 全体の意味・・・1molのプロパンの完全燃焼で2219[kJ]の熱を生成物が放出
- 燃焼反応では燃焼する物質を1molとする
生成反応
生成反応についてです。これは単体と単体を結合させて化合物を作るときとかの反応です。
炭素と水素を反応させてメタン(CH4)を作る反応を考えてみましょう。
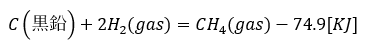
- 式の左辺・・・黒鉛と水素が反応
- 式の右辺・・・メタンが生成
- 式全体の意味・・・黒鉛と水素で1molのメタンができる反応で74.9KJの熱を放出
- 生成反応では生成物を1molとする。
中和反応
中和反応についてです。これは、酸と塩基を反応させて中和させる反応です。
基本的に中和反応は溶液に関する反応なので水に溶けています。
だから、添え字にaqua(アクア)のaqを付けます。これは水に溶けていますよという意味です。
塩酸と水酸化ナトリウムの中和反応を熱化学方程式に示します。
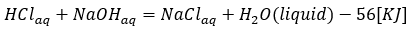
- 式の左辺・・・塩酸と水酸化ナトリウムが反応
- 式の右辺・・・塩化ナトリウムと水の生成
- 式全体の意味・・・酸と塩基の反応で塩と1molの水が生成
- 中和反応では生成する水を1molとせよ
物理変化に対する状態変化
物理変化に対する状態変化は以下の3つです。
- 物質の三態に関する変化
- 物質の溶解
- 物質の水和
これらについて個別に解説します。
物質の三態に関する変化
物質が固体や液体、気体に変化する際にやり取りする熱についてです。
- 固体→液体・・・融解熱
- 液体→気体・・・蒸発熱
- 固体→気体・・・昇華熱
- エネルギーは高い方から順に気体→液体→固体
ところで、物質と温度のグラフを描くと、状態変化しているときに温度変化はありません。
これは、ヒーターから与えられる熱とかを温度変化に使っているのではなく、状態変化にのみ使っているからです。
水が液体から気体になるときの変化についてです。
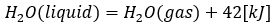
- 式の左辺・・・液体の水
- 式の右辺・・・気体の水
- 式全体の意味・・・水を状態変化して液体から気体にする。1molで42KJの熱を受け取る
物質の溶解
物質の溶解熱に関してです。これは、気体の物質を液体(水ならaq)に溶かしたときの熱化学方程式です。
水酸化ナトリウムを水に溶かしたときの変化を考えましょう。
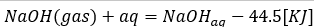
- 式の左辺・・・気体の水酸化ナトリウムを水に投入
- 式の右辺・・・水酸化ナトリウムが水に溶けて水溶液に
- 式全体の意味・・・水酸化ナトリウムを水に溶かす。44.5KJの熱を放出
- 溶解反応では投入物質を1molとせよ
物質の水和
物質の水和熱とは、気体のイオンを水に投入したときにやりとりする熱のことです。
カリウムイオンを水に溶かすして水和する反応を考えます。
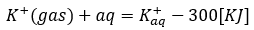
- 式の左辺・・・気体のカリウムイオンを水に投入
- 式の右辺・・・カリウムイオンが水と水和
- 式全体の意味・・・カリウムイオンを水に溶かす。300KJの熱を放出
- 水和反応では投入する気体イオンを1molとせよ
原子や分子の結合
原子や分子の結合に関する反応は以下の4つです。
- 結合エネルギー
- 格子エネルギー
- イオン化エネルギー
- 電子親和力
これらについて個別に解説します。
結合エネルギー
これは、分子に働く共有結合を断ち切って原子にする(ばらばらにする)のに必要なエネルギー(熱)です。
例えば、酸素分子をバラバラにして酸素原子にする反応を考えます。
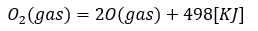
- 式の左辺・・・気体の酸素分子
- 式の右辺・・・気体の酸素原子
- 式全体の意味・・・酸素分子を酸素原子にして、498KJを外から受け取る
- 共有結合の数を1molとせよ
注意しなければならないのが共有結合の数ということです。例えば、メタンの水素と炭素の結合エネルギーを考えるときに・・・
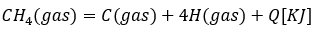
結合エネルギーをそのままQと書いてはいけません。何故なら、C-H共有結合の数は4つです。だから、Qを4で割った値が結合エネルギーです。
必ず、求めるものの共有結合の数を考えてください。
格子エネルギー
これは、固体の結晶をバラバラにして気体の陽イオンと陰イオンにするために必要なエネルギーのことです。
塩化ナトリウムを例にして考えます。
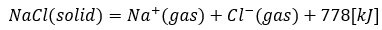
- 式の左辺・・・固体の塩化ナトリウム結晶
- 式の右辺・・・ナトリウムイオンと塩素イオン
- 式全体の意味・・・固体結晶をバラバラにして気体のイオンにし、778KJ吸収
- 結晶を1molとせよ
イオン化エネルギー
これは、前回の記事でも解説しましたが、イオン化エネルギーは原子から電子を1個取り去って1価の陽イオンにするために必要なエネルギーです。
カリウムを例に解説します。
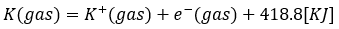
- 式の左辺・・・カリウムの原子
- 式の右辺・・・カリウムイオンと電子1個
- 式全体の意味・・・カリウムから電子1個を取ってイオンに→418.8KJを吸収
- 気体原子を1molとせよ
電子親和力
これは、前回の記事でも解説しましたが、「原子が電子を1個受け取って1価の陰イオンになるときに放出すエネルギーです。
フッ素を例に示します。
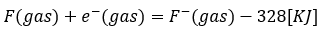
- 式の左辺・・・フッ素の原子と電子一個
- 式の右辺・・・フッ素イオン
- 式全体の意味・・・カリウムが電子1個を受け取ってイオンに→328KJを放出
- 気体原子を1molとせよ
物質の状態とエネルギー図
ここで、問題を解く際に知っているとラクになるエネルギー図というものを紹介します。
これは、物質の状態によるエネルギーの序列を図に表したものです。
ここで、上に出てきた物質の状態をまとめてみます。
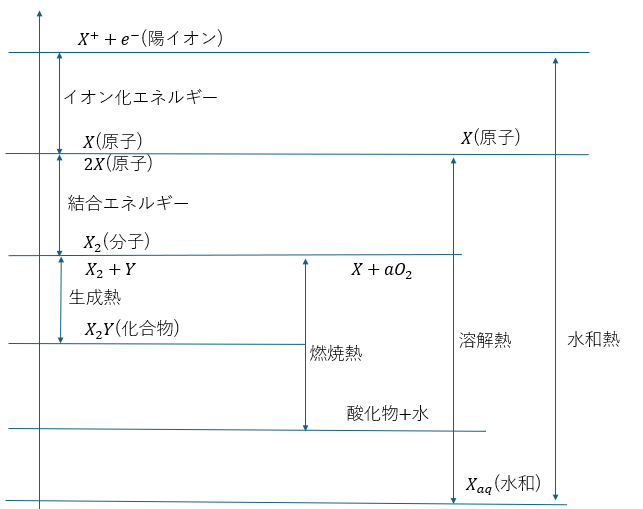
熱化学方程式では問題の内容で様々な状態や化学反応式が出てくるので複雑になります。エネルギー図を有効活用してください。
次回は、ヘスの法則とエネルギー図を使って実践問題に取り組んでみます。



コメント