こんにちは。Horyです。
今回の記事から熱化学方程式に関して解説しようと思います。この分野は考え方が新課程と旧課程で大きく変わった分野なのでそれらも含めて熱化学方程式をまとめます。
今回も頑張りましょう。
化学反応と熱
化学反応で熱が発生する理由を皆さんは説明できますか?
これは、原子と原子が結合するときに必ず結合エネルギーというエネルギー(熱)が必要という側面を考えれば分かるはずです。
例として水素と酸素で水ができる反応を考えてみます。
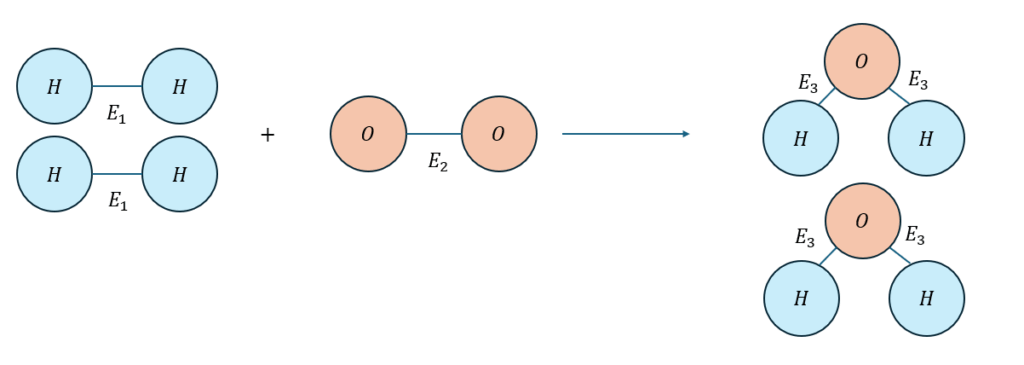
このように考えると、E1とE2とE3はそれぞれ値が違います。
つまり、反応前と反応後の結合エネルギーは値が違うので、その差分が熱として反応に寄与すると見ることができます。
熱化学方程式
熱化学方程式の前に化学反応式との違いを抑えましょう。
- 化学反応式
- 目的;反応前後でどうなった? (→でつなげ)
- 係数;反応に関わった粒の数はどのくらい? (必ず自然数)
- 物質の状態;書く必要ない
- 熱化学方程式
- 目的;反応前後で出入りした熱はどうだ? (=でつなげ)
- 係数;物質量 (正の実数・・・少数や分数もOK)
- 物質の状態;書く必要あり (物質の状態でエネルギーが違う→反応熱も違う)
以下に気体の水素と酸素で液体の水が生成する反応を化学反応式と熱化学方程式で示します。

熱化学方程式 新課程と旧課程の違い
熱化学方程式は新課程と旧課程で大きく変わりました。
新課程ではエンタルピーの定義を熱化学方程式に盛り込んでいます。
これについて調べるとごちゃごちゃ難しいことが書いてありますが、分かりやすく説明すると・・・
- 新課程・・・反応前後で物質はどの程度の熱やエネルギーを吸収or放出
- 旧課程・・・反応前後で外はどの程度の熱やエネルギーを吸収or放出
要するに、主語が変わっただけで本質は何も変わっていません。水が生成する反応を用いて図に示します。
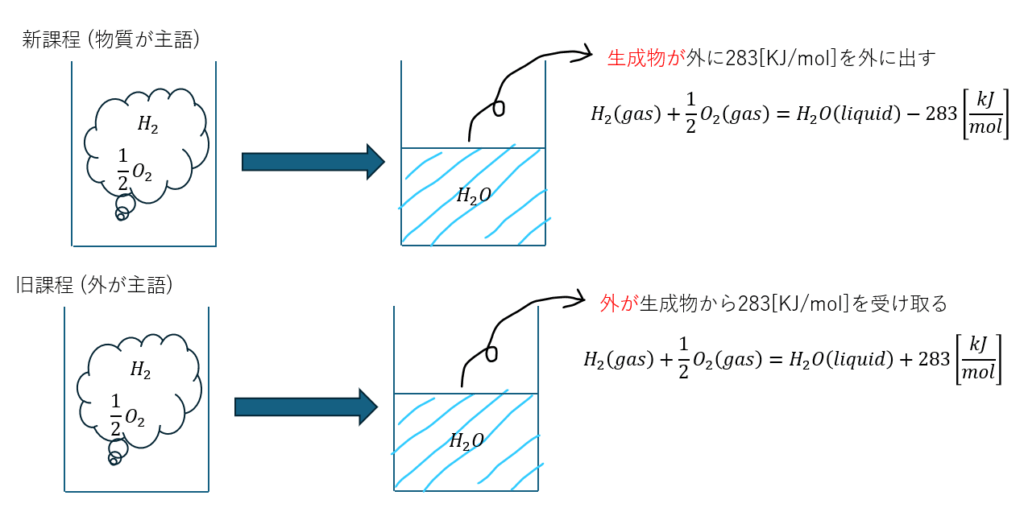
熱化学方程式は新課程で覚えるとともに、主語は物質が持つ熱やエネルギーをどうしたのかということを念頭においてください。
熱化学方程式の熱とエネルギーの違いについて
熱化学方程式の熱とエネルギーの違いについてです。物理における熱とエネルギーではなくて高校の熱化学方程式であることに注意してください。
物質Xと物質Yの反応を例に示します。
- 反応熱・・・化学反応等をするときに物質が吸収or放出する熱
- エネルギー・・・物質をバラバラにするために物質が吸収or放出する熱
- 分子をバラバラにして原子にする・・・結合エネルギー
- 結晶格子をバラバラにしてイオンにするエネルギー・・・格子エネルギー
これらについて個別に紹介します。
反応熱
反応熱について図を用いて解説します。
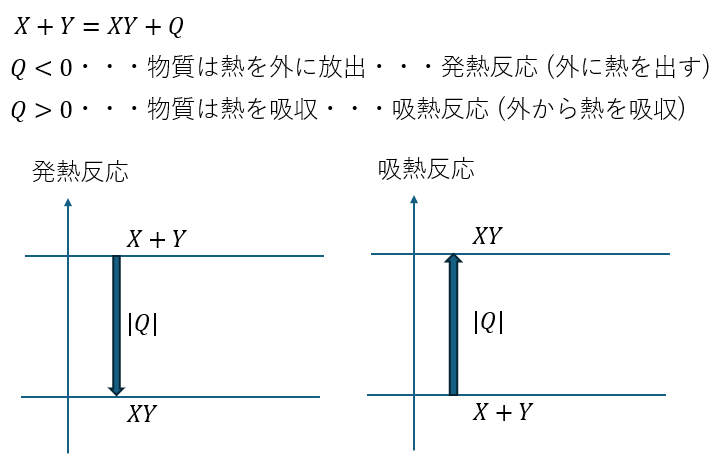
エネルギー
高校化学の熱化学方程式では反応熱と結合エネルギーや格子エネルギーも単位は同じ[KJ/mol]で、どちらも熱と思っても差し支えないと僕は考えています。
(何でエネルギーって言ってるか分からんけど、、、少なくとも誤解を生むし、結合熱とか格子熱とかにすればいいのにと個人的に思っています)

まとめ
今回の記事のまとめです。
熱化学方程式は旧課程と新課程で内容や考え方が大きく変わった分野になります。
しかし、必ず、反応前後で物質のエネルギーがどうなってその過程で物質は熱やエネルギーを得たのかor失ったのかを念頭に入れておいてください。
次回の記事では様々な反応と熱化学方程式をまとめるとともに、エネルギー図にも触れたいと思います。



コメント