こんにちは。Horyです。
これまでの記事で物質が溶ける原理や濃度計算の原理を簡単に解説しました。
その中で溶解度について解説し、固体の溶解度は「水100gに対してどのぐらいの量溶けるのか」という数値を示したものです。
今回は固体の溶解度に関して簡単にまとめるとともに、溶解度の問題が出たらどうやって対処するかに関しても解説しようと思います。
今回も頑張りましょう。
溶解度とは・・・
溶解度とは「水100gについて溶質(固体)が最大どのぐらい溶けるか」を表したものです。

注意してほしいのが水和水の場合は水と水和水の質量の和が100gであることに注意してください
(溶質に水和水を組み込むことはせずに水和水は溶媒に組み込んでください)。
溶解度曲線
基本的に溶解度曲線で出てくる問題は溶液の温度を冷やしたときに溶質がどの程度析出するかを求める問題が出ます。
ひとまず、物質Xの溶解度曲線を以下に示します。
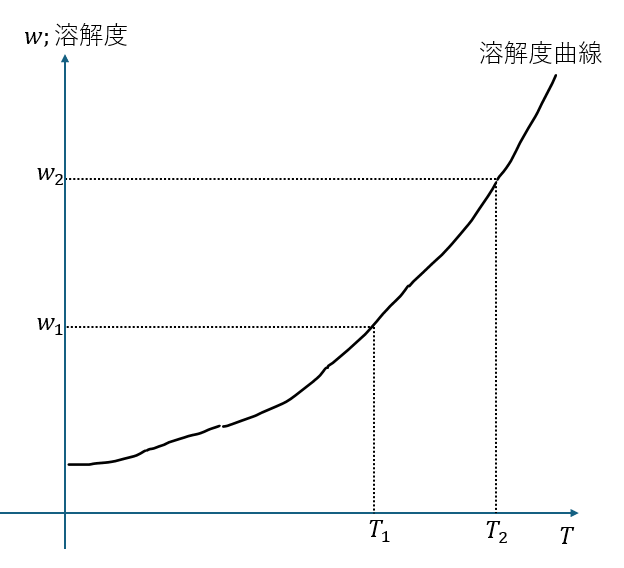
T2→T1で温度を冷やしたときの溶質の析出量を単純な引き算で求めないでください。
どういうことかというと以下のように簡単にしないでほしいということです。

上の式が成立するのは水の量が常に100[g]で一定の時のみです。
問題では以下のことが起こりえます。
- 水の蒸発
- 水を追加投入
- 水和物を投入
上のように水の量が変わると通用しません。水の量が変動するときの対処について次項で話します。
水の量が変動するときの対処
問題で溶解度曲線が表されてたとしても水の量が蒸発とか追加投入とかで変わったらどのくらい溶けるとかの計算無理じゃね?
と思うかもしれませんが、無理じゃありません。なぜなら、水の量が変化したとしても。水の質量に対して溶ける溶質の比は変化しないからです。
温度が一定のTで水に溶ける量を以下のように設定します。

上のように、自分が求めたい温度の溶解度と水の質量さえ分かっていれば比を用いて溶ける量を求めることができます。
実践問題 ① 水の蒸発による析出
実線問題に取り組みます。パラメータを以下のように設定します。ただし、物質Xの溶解度曲線は上の図に示した通りとします。

温度を冷やしたときにどの程度析出するかを考えます。
こういう問題は析出温度での溶解度曲線の状況と問題の状況を照らし合わせて比の式を作ることが先決です。

上のパラメータを用いて溶解度の比の式を作ると・・・
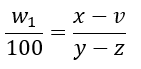
上の等式を析出量vについて解くことで答えが出てきます。
実線問題② 水和物の溶解度
皆さんの悩みの種になっている水和物の溶解度についてです。
水和物を硫酸銅五水和物と仮定して、上に示した溶解度曲線は硫酸銅の溶解度曲線と考えて問題を解いてください。
パラメータを以下のように設定します。

- 赤い部分・・・硫酸銅五水和物全体に対する水和水の割合(モル比)
- 青い部分・・・硫酸銅五水和物全体に対する硫酸銅の割合(モル比)
上のことを利用して比の式を立てていきます。
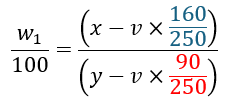
上の式を解いてvの値を求めれば勝ちです。


