こんにちは。Horyです。
前回の記事では溶質が溶媒に溶ける原理を解説しました。
この中で溶質と溶媒の相性が大切だということも学習し、分子間力がキーワードになることも話しました。
今回の記事では溶液の濃度計算と計算における単位の重要性に関しても話します。
今回も頑張りましょう。
濃度の計算
濃度の計算とはどういうことかというと、基準の量に対して溶質はどれだけ溶けているのか?ということを計算することです。
ここで、基準の量というのは・・・
- 「溶媒」に対して溶質がどれだけ溶けている?
- 「溶液=溶質+溶媒」に対して溶質がどれだけ溶けている?
ということです。
結局、上の二つの基準のうち「どっちなんだ?」ということですが、問題によって違います。
どっちなんだ問題
問題で求める量によって基準を溶媒にするか・溶液にするかはかなり違ってきます。
- モル濃度
- 質量モル濃度
- 質量パーセント濃度
- 溶解度
- モル分率
これら5つに対して、どういう量であるかを解説していきます。ここから、単位も意識してください。
モル濃度
モル濃度は「溶質の物質量を溶液の量(L)で割った量」です。
式で表すと以下のようになります。
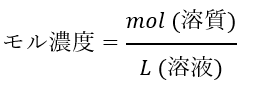
「1Lの溶液に溶質が何mol入っているか?」ということを表しています。
質量モル濃度
質量モル濃度は「溶質の物質量(mol)を溶媒の質量(kg)で割った量」です。
式で表すと以下のようになります。
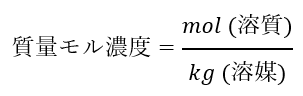
「1kgの溶媒に溶質が何mol溶けているのか?」ということを表しています。
質量パーセント濃度
質量パーセント濃度は「溶質の質量(g)を溶液の質量(g)で割った量に100を掛けた値」です。
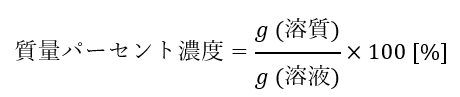
「溶液100gに溶質は何g溶けているか」というように言い換えてもいいです。
ちなみに、後からやりますが、水和物の場合は溶質を無水物で考えます(受験生の悩みの種)。
溶解度
溶解度は「水の質量(g)に対して溶ける最大限の溶質(g)を溶かしたとき、溶質の質量を水の質量で割った量」です。
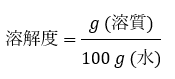
「水100gに対して溶質は最大どのくらい溶けますか?」という風に言い換えてもいいです。
質量パーセント濃度との違いに注意してください。
モル分率
モル分率は「溶質の物質量(mol)を溶液の物質量(mol)で割った量」です。
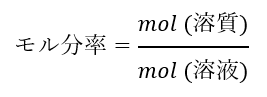
「溶液1molについて溶質は何mol溶けるか」ということを表しています。
単位は無次元の量です。
濃度の計算と単位の重要性
上で言った単位の中でよく出てくるのは以下の二つです。
- モル濃度
- 質量パーセント濃度
ここで、問題文に出てくる情報を以下のように設定します。
- モル質量M [g/mol]・・・1[mol]で何グラム[g]か
- 密度d[g/mL]・・・溶液1[mL]は何グラム[g]か
- 質量パーセント濃度x[%=g/100]・・・溶液100gに溶質は何g入ってる
また、念のためですが、水の場合、「1L=1000mL」で「1L=1000g」というのは小中学校でやったことなので当たり前です。
ここで、モル濃度C[mol/L]は「1L=1000mLに何molあるか」というのを示しています。
さて、モル濃度Cと質量パーセント濃度xの関係式を求めてみます。
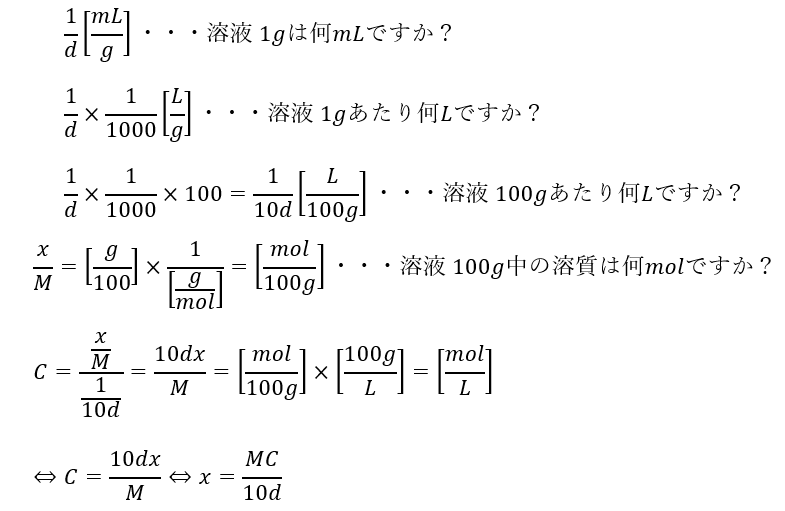
これで質量パーセント濃度とモル濃度の関係を割り出せました。
物理計算・化学計算では単位を大事に扱ってください。
値と単位の価値は同じです。物理・科学計算で単位を軽視する人は値を軽視しているも同じです。
水和物の計算
質量パーセント濃度とかで一番やばいのは水和物の計算です。
例えば、以下の化学式で表される硫酸銅五水和物を考えます。
以下に示すのは硫酸銅五水和物の化学式です。

- 赤い部分だけ計算せよ・・・水和物から水和水を取り除け
- 青い部分・・・溶質には組み込むな
- molで考えるなら水和水の影響はない
例えば、水50gに五水和物を50g溶かしたときの質量パーセント濃度を考えます。

水和物の質量パーセント濃度は上のように求めます。計算頑張ってください。


