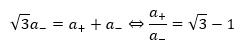こんにちは。Horyです。
前回の記事では化学結合の基本的な内容を説明しました。
そして、単位格子に関しては金属結晶に焦点を当てて以下の記事で解説しました。
今回の記事ではイオン結晶に関して復習も兼ねて性質をまとめると共に、これらの結晶構造に関して詳細に解説します。
今回も頑張りましょう。
イオン結晶に関して・・・
イオン結晶とは、イオン結合からできる結晶です。
性質としては以下のことが挙げられます。
- 強い力で壊れる(硬くて脆い)
- 融点が高い
- 固体で電流流さないが、液体で電流が流れる
これらに関して個別に解説します。
硬くて脆い
これについては、前回の記事でも解説したとおりですが、イオン結合は電気陰性度の大きい原子と小さい原子の結合です。
陽イオンになりやすい原子と陰イオンになりやすい原子が互い違いに並んでクーロン力により結合しています。
外部から強い力が加わると配置ずれるので同符号のイオンが並んで斥力により反発します。
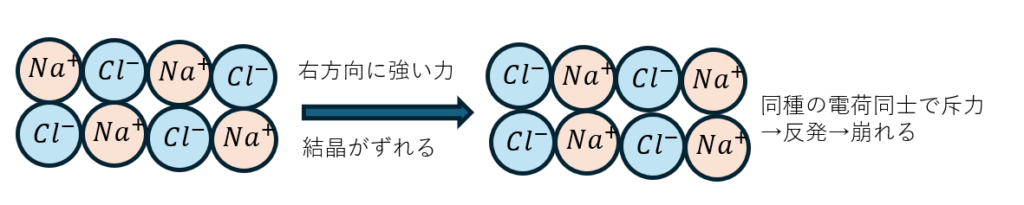
だから、非常に強い力が加わると砕けます。何気ないことですが、この記事の最後の方で大事になる考え方です。
融点が高い
イオン結晶の融点は格子エネルギー(結晶を気体の粒子にまでバラバラにするのに使うエネルギー)大きい方が高くなる傾向があります。
そして、格子エネルギーの大きさはクーロン力の大きさに比例します。
だから・・・イオン結晶の融点を高くする因子は・・・
- イオンの価数が大きいほど電荷量が大きくなりクーロン力も大きくなる
- イオン間距離が小さいほどクーロン力が大きくなる
- 配位数が多いほどクーロン力が大きくなる
上の条件がイオン結晶の融点を高くする要因ですが、特に価数の影響は大きいです。
例えば、一価同士の塩化ナトリウム(NaCl)よりも二価同士の酸化バリウム(BaO)の方が融点は圧倒的に高いです。
固体・液体 電気伝導性
これは、前回の記事でも説明したとおりですが・・・
- 電気陰性度が小さい原子の周りに電気陰性度が大きい原子が集まる
- 電気陰性度の大きい原子が電子を引き付ける
- →結晶状態では電子が拘束されているので電気流さない
- →水に溶けてイオンになると動けるので電気を通す
イオン結晶の構造
高校化学で出てくるイオン結晶は主に2つです。最後の1つは応用でたまに出ます。
- NaCl型 (岩塩型)
- CsCl型 (塩化セシウム型)
- ZnS型 (閃亜鉛鉱型)・・・応用
これらについて個別に解説します。
NaCl型 (岩塩型)
以下に示すのは岩塩型の結晶構造です。以下に特徴を示します。
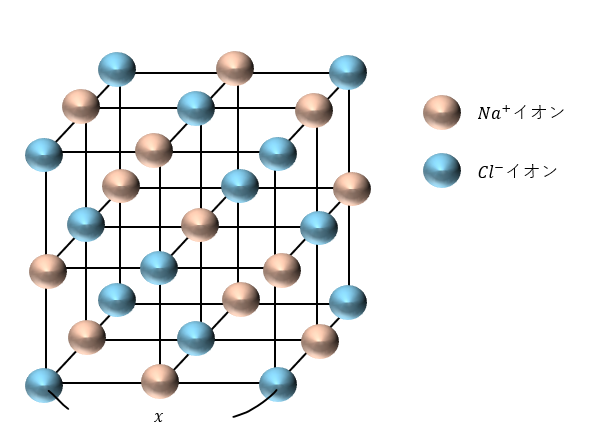
- 陽イオンまた、陰イオンだけ見ると面心立方格子
- 陽イオンと陰イオンがそれぞれ4個
それぞれの文字に関しては前回の記事をご参照ください。陽イオンの半径・陰イオンの半径をそれぞれa+,a-と見ると・・・
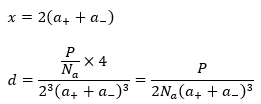
以上で密度を求めることができました。
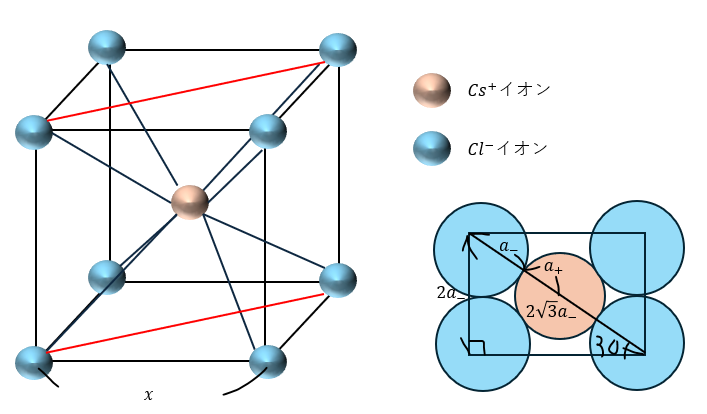
CsCl型 (塩化セシウム型)
以下に示すのは岩塩型の結晶構造です。以下に特徴を示します。
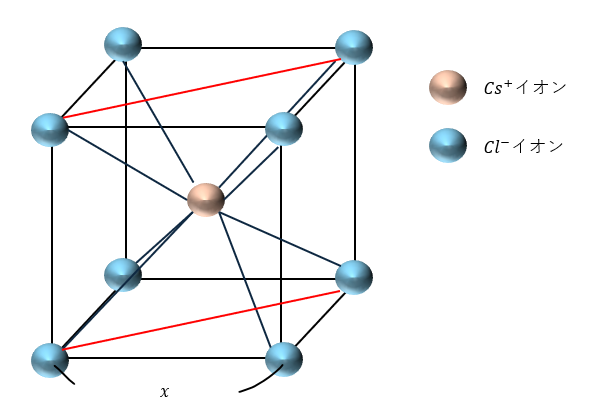
- 全体で体心立方格子
- 陽イオンと陰イオンが1個ずつ
また、赤い長方形の断面を見ると・・・
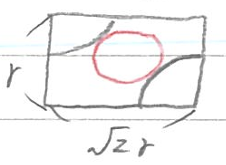
それぞれの文字に関しては前回の記事をご参照ください。陽イオンの半径・陰イオンの半径をそれぞれa+,a-と見ると・・・
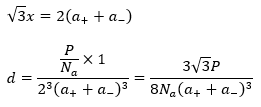
以上で密度を求めることができました。
ZnS型 (閃亜鉛鉱型)
以下に閃亜鉛鉱型の結晶構造を示します。
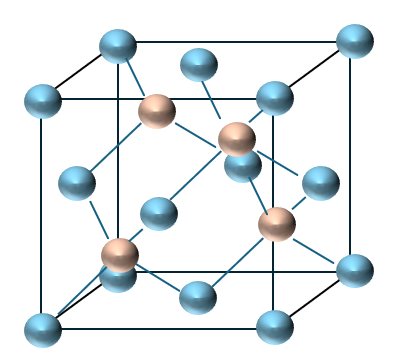
まぁ、これに関してはほとんど出てこないので安心してください(出てきたとしても丁寧な誘導があると思います)。
結晶構造を見ると次の記事で紹介するダイアモンド型の結晶構造に似ていますね。
限界半径比
上の解説でイオン結晶に強い力を与えると、配列がずれることで同種のイオン同士で反発して結晶が壊れるという説明をしました。
イオン結晶の単位格子について、陽イオンと陰イオンの半径比によって、同種の電荷を持つイオン同士が近づきすぎると結晶構造を維持できなくなります。
こんな時の陽イオンと陰イオンの半径比を限界半径比といいます。
- 陽イオン・・・元の原子と比較して半径は小さい
- 陰イオン・・・元の原子と比較して半径は大きい
上で説明したそれぞれの結晶構造の限界半径比を求めていきます(閃亜鉛鉱型は除く)。
NaCl型 (岩塩型)
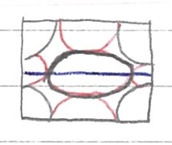
岩塩型の単位格子の限界半径比を求めていきます。以下に図を示します。
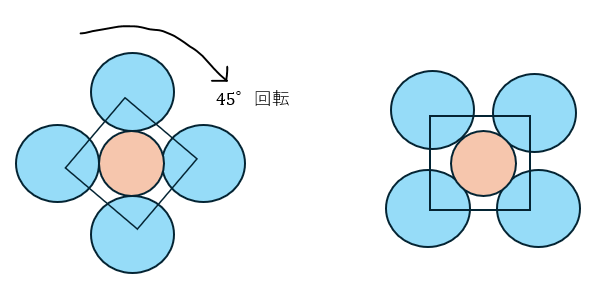
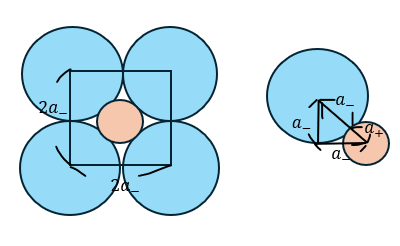
上の図から限界半径比は・・・
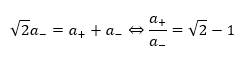
CsCl型 (塩化セシウム型)
塩化セシウム型の限界半径比を求めていきます。