こんにちは。Horyです。
前回の記事では化学結合に関する原理とプロセスを簡単に解説するとともに、電気陰性度について詳しく説明しました。
この説明の中で電気陰性度は「お前の電子は俺のもの・俺の電子は俺のもの」という思いの強さを数値化したものということも話しました。
上に説明した概念は非常に大切なので最後の方まで使えます。覚えておいてください。
今回の記事では、前回のちょっとした復習を行うとともに、化学結合の種類とそれぞれの原理を簡単に解説します。
今回も頑張りましょう。
価電子について・・・
価電子について説明します。
- 荷電子
- 希ガスを除く典型元素・・・最外殻電子が価電子
- 遷移元素・・・最外殻電子(内側の電子も含む)
基本的に、典型元素の最外殻電子は頭に入れておいてください。また、希ガスの最外殻電子は0個になることも覚えておいてください。
- Na・・・価電子は1個
- Mg・・・価電子は2個
- C・・・価電子は4個
- Cl・・・価電子は7個
- He・・・価電子は0個
基本的に化学結合にかかわる電子は最外殻電子になります。
電子対に関して (前回の復習)
電子対に関して、前回の復習もかねて解説します。
- 価電子・・・最外殻電子の数
- 電子対・・・最外殻電子で二つがペアになったもの
- 不対電子・・・最外殻電子で二つペアにならなかったもの
- 共有電子対・・・原子の結合により互いの不対電子がペアとなったもの
- 非共有電子対・・・結合の前からペアになって存在する電子対
酸素原子が酸素分子になる例で解説します(前回やった)。
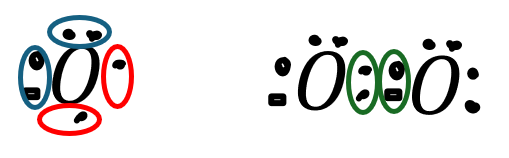
- 赤い丸・・・不対電子
- 緑の丸・・・共有電子対
- 青い丸・・・非共有電子対
また、元素一つを見たときに、その原子が別の原子と最大で何個結合できるかを考えたときに、結合できる最大数のことを原子価といいます。
基本的に原子価はその原子が水素原子と最大何個結合できるかを考えればよいです。
例えば、炭素原子であれば原子価は4個になります(これは覚えておいた方がいい)。
また、原子を考えたときに、電子が何もない場所を空軌道といいます。空軌道は典型元素では1族や2族をはじめとした金属原子に多いです。
例えば、Naを例にすると、Naの価電子は1個なので・・・

点線で囲った部分が空軌道になります。
結合の種類と電気陰性度について・・・
高校で習う化学には大きく分けて3種類の結合があります。
- ①;金属結合
- ②;イオン結合
- ③;共有結合
また、前回の記事で電気陰性度の周期性は話したと思います。
ここで、電気陰性度の周期性は前回の記事でも説明しましたが、典型元素では希ガスを除いてイオン化エネルギーにその傾向が似ています。
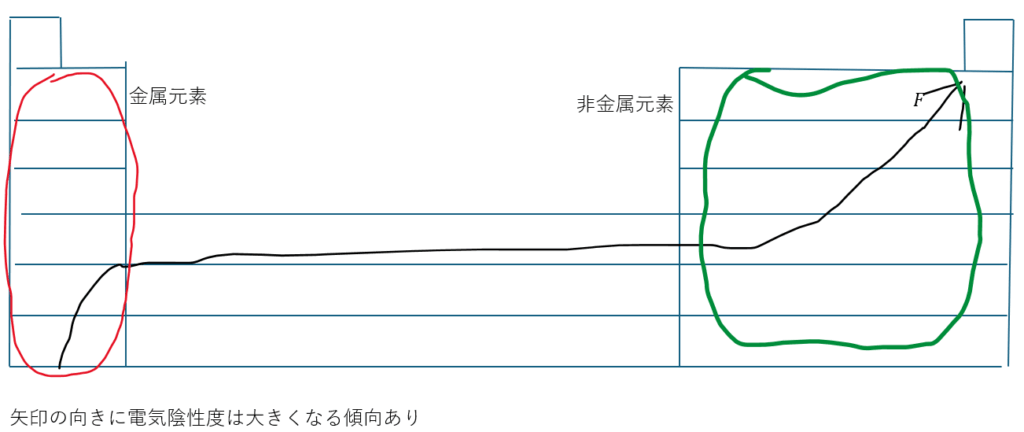
上の図を考えてみると(Fの電気陰性度は4で最大)希ガスを除いた典型元素では・・・
- 金属元素は比較的に電気陰性度が小さい
- 非金属元素は金属元素と比べると電気陰性度が大きい
このことを踏まえて①~③の結合の原理を解説します。
金属結合
金属結合とは、電気陰性度が比較的小さい金属が結合することです(基本的に同じ金属同士で結合し、結晶を作ります。この結晶を金属結晶といいます)。
金属には以下の性質があります。
- 電気を伝えやすい (電気伝導性)
- 熱を伝えやすい (熱伝導性)
- 展性・延性に富む
- 金属光沢の発現
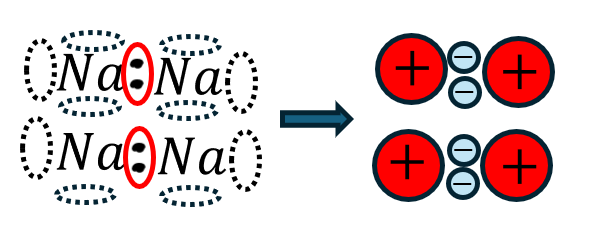
金属結合を詳細に解説すると・・・
- 金属元素は電気陰性度が小さい(電子を拘束しようとしない)
- 金属元素は空軌道をたくさん持つ
- →だから、金属結晶内を電子が自由に動ける→自由電子
- →自由電子が熱や電気を運ぶ→電気伝導性・熱伝導性が高い
- 電子が自由電子で自由に動く
- →原子が陽イオン(正電荷)/自由電子(負電荷)
- →自由電子と陽イオンがクーロン力で引き合う
- →クーロン力による引力で決勝が規則正しく配列
イオン結合
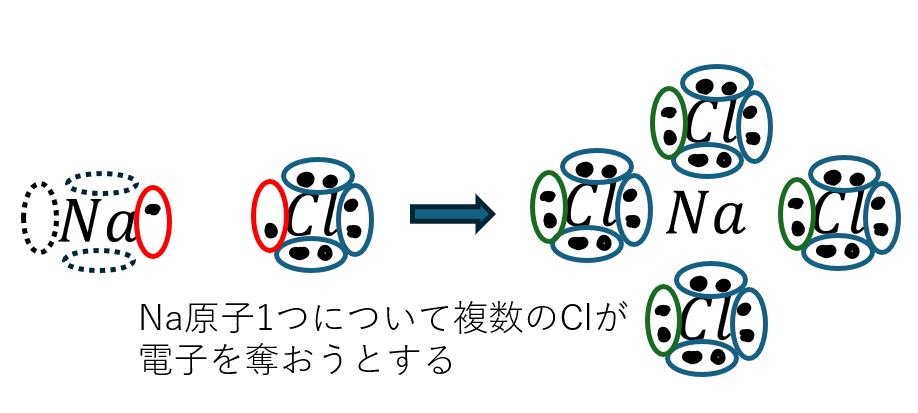
イオン結合とは、電気陰性度が大きい原子と電気陰性度が小さい原子が結合することです。
- 電気陰性度が小さい原子・・・陽イオンになりやすい
- 電気陰性度が大きい原子・・・陰イオンになりやすい
- 金属原子と非金属原子はイオン結合を起こしやすい(もちろん、非金属同士もイオン結合あるよ)
- 電気陰性度が小さい原子の周りに電気陰性度が大きい原子が集まる
- 電気陰性度の大きい原子が電子を引き付ける
- →結晶状態では電子が拘束されているので電気流さない
- →水に溶けてイオンになると動けるので電気を通す
中学校でも習ったと思いますがNaCl(塩化ナトリウム)は代表的なイオン結合の物質です。
また、イオン結晶は硬くて脆いと言われています。その理由は・・・
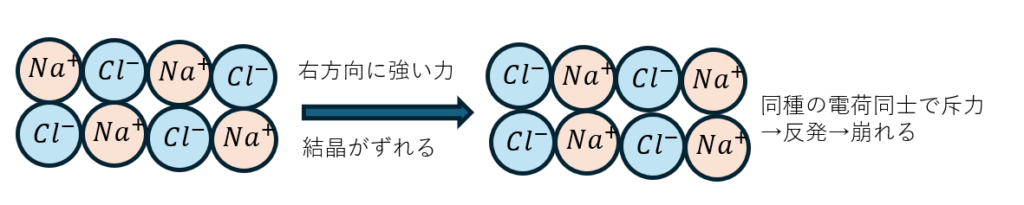
共有結合
比較的に電気陰性度の大きい原子が結合(主に非金属元素同士)すると共有結合を形成します。
共有結合には3つの種類の結晶があります。
- 共有結合結晶
- アモルファス
- 分子結晶
これらについて個別に解説します。
共有結合結晶
共有結合結晶は共有結合だけで結合して、配列が同じパターンで結晶化した結晶になります。
ダイアモンドや二酸化ケイ素(SiO2)などが共有結合結晶を形成します。
以下にダイアモンドの結晶を示します。
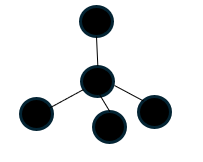
ダイアモンドの結晶(炭素)は上に示す基本パターンが無数に合わさって結晶化した結晶です。
当然ですが、電気陰性度が大きい元素同士が、しかも規則正しく配列しているのでダイアモンドは非常に硬く頑丈です。
ここで、疑問に思うことがあります。「グラファイト(黒鉛)も共有結合結晶だけど、脆くないか?」ということに・・・後で理由を説明します。
グラファイト(炭素_黒鉛)や二酸化ケイ素に関しても結晶構造を調べてみてください。
アモルファス
アモルファスも共有結合で結合していますが、共有結合結晶と違う点は配列が同じパターンで結晶化しておらず完全にランダムになります。
そのため、結晶とは呼べず、無定型固体(アモルファス)と呼ばれています。
二酸化ケイ素(SiO2)のアモルファス状態をガラスと呼んでいます。
分子結晶
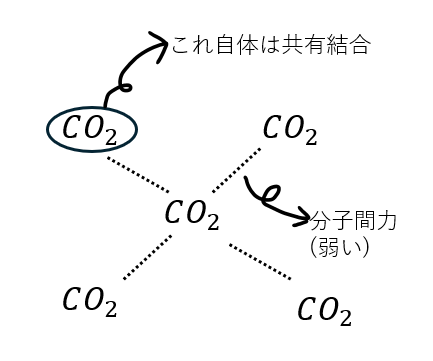
共有結合で結合した分子同士が分子間力で繋がった結晶を分子結晶といいます。
例を挙げるとドライアイス(CO2)やナフタレンが分子結晶を形成します。
分子間力は他の結合と比較すると極めて弱いです。だから、分子結晶は非常に脆く、沸点・融点も低いです。
ドライアイスの例を以下に図で示します。
ここで、黒鉛が共有結合結晶なのに脆い理由ですが・・・
共有結合結晶でグラファイト(黒鉛)のみが分子間力が結晶中に存在します。だから、グラファイトは層状にボロボロ剥がれます(層間に分子間力が働く)。
今回はこれで終わりです。各結合の特性を理解しておきましょう。


コメント