こんにちは。Horyです。
前回の記事では化学発展の発端になった原子説・分子説について簡単にまとめると共に原子構造解明の経緯を簡単に紹介しました。
今回の記事では電子殻の基本構造と電子の配置について簡単にまとめました。
今回も頑張りましょう。
電子殻の基本構造
前回の記事で原子は原子核と電子で構成されていて、電子は原子核の周りを周回軌道していることも話しました。
この軌道のことを我々は電子殻と呼んでいます。電子殻にはそれぞれに名前がアリ、それぞれの電子殻に収容できる電子数も決まっています。
以下に図を示します。
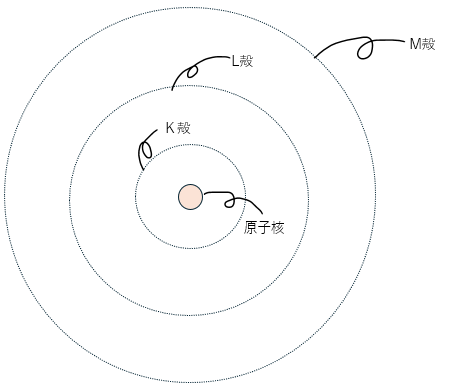
上の図にはK,L,Mだけですが、電子殻はもっとたくさんあります。
ここで、電子殻・最大電子収容数・電子殻半径を以下の表にまとめます。
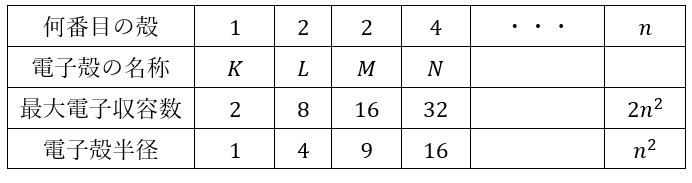
ここで、疑問なのが電子は何でこのような周回軌道しかとれないのかということです(軌道が円形であること・飛び飛びの軌道でアルコと)。
これを説明すると、大学の量子力学になるので、この記事では説明しません(この記事の物理の記事で説明しますので、今はそういうもんか程度でおいておいてください)。
電子の配置方法
電子の配置方法についてです。
エネルギー的に最も安定な状態を基底状態といいます。ここでは、基底状態の電子配置の方法を説明します(そうじゃない状態を励起状態という)。
- 電子は「一般的に」内側の殻→外側の殻と配置される
- 殻電子殻について、最大収容数より多く電子が配置されることはない
基本的に電子は内側から外側に配置されますが、
例外的にM殻とN殻のみ、M殻に8個配置された後にN殻に2個配置され、その後に、M殻に配置されます(遷移元素の時に思い出すと良いです)。
一応、以下に周期表と対応する原子の最外殻の電子殻の名称を示します。

上の表では第5周期まで書いてみました。
イオンの電子配置については・・・
- 陽イオン・・・最外殻から電子を抜き取れ
- 陰イオン・・・最外殻に電子を入れろ
電子配置の書き方
電子配置の書き方について解説します。
まずは、原子の電子配置の書き方についてデス。以下に簡単な例を示します。
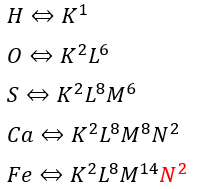
鉄などの遷移元素が出たときは注意してください。遷移元素の一部はK→L→Mと来ますが、Mに8個配置された後、Nに2個配置され、その後、残りのMに配置されます。
続いてイオンの電子配置についてデス。
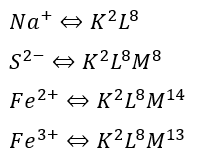
ここで、6族のクロム(Cr)や11族の銅(Cr)はイオンになるときの電子配置に注意が必要です。
なぜなら、陽イオンになるときに単純に最外殻電子が取り払われるだけでなく、別の殻に移動するからです(また今度)。
イオンの電子配置とオクテット則
周期表の1番右側(18族)の元素を貴ガス元素といいます。
ヘリウムを除いた貴ガス元素は最外殻に電子が8個入った状態が安定です(Heは2個)。この、最外殻に電子が8個状態をオクテッド状態といいます。
希ガスやイオンもオクテッド状態ですが、共有結合もオクテッド状態と言えます。
ちなみに、教科書とかに希ガスは安定で反応に乏しいとか書いていますが、反応しないわけではありません。高温・高圧など条件を非常に厳しくすれば反応します。
典型元素と遷移元素
典型元素と遷移元素の特徴は覚えておいた方が良いです。
- 典型元素
- 周期表の1,2,12~18族の元素
- 最外殻電子は周期的に変化
- 周期表の縦に似た性質
- 遷移元素
- 周期表の3~12族の元素
- 最外殻電子はほぼ同じ (1~3個)⇔ほとんどが陽イオンになる
- 周期表の横方向に似た性質
典型元素は周期表の縦方向で似た性質を持ちますが、縦方向(族)でもグループ分けをします。
特に覚えておいた方が良い物は・・・
- Hを除く1族元素・・・アルカリ金属
- 2族元素・・・あるかり土類金属
- 17族・・・ハロゲン元素
- 18族・・・貴ガス元素
ここら辺の話は無機化学でもやりますが、覚えておくべきかと思います。


コメント