こんにちは。Horyです。
いよいよ、金属陽イオンの特定方法と系統分析のまとめについてです。
この記事の内容はとても大事で、テストでも頻出します。何故なら・・・
上の3つの記事の内容をまとめて出題できるからです。
今回も頑張りましょう。
系統分析とは何か・・・?
系統分析とは無機化学では「未知の金属陽イオンの特定のために行う操作」のことです。
具体的にどうやって特定するかというと、特定の操作についての結果で・・・
- 沈殿ができたとして色はどう?
- 沈殿は再び溶けた?
上の二つがどうなっているかを考えてどんな金属の陽イオンが入っているかを分析することです。
系統分析の流れと操作
当然ですが、イオン化傾向を利用します。
復習のためにイオン化傾向の図を以下に示します。

以下に示すのは系統分析の一連の流れです。
- ①;陽イオンを沈殿させる (液性などの条件も大事)
- ②;沈殿を再溶解させる
- ③;再び沈殿させる
①~③の流れを何回も繰り返すことによって溶けている金属陽イオンを絞り込んでいきます。
高校化学では主に1~6グループに分けられて、1→6の順に系統分析の作業は進行していきます。
- グループ1;塩酸でXClの塩化物の沈殿 (溶液が酸性に)
- グループ2;酸性溶液に硫化水素H2S投入→硫化物XSの沈殿 (酸性状態)
- グループ2.5;煮沸して硝酸HNO3を少量投入
- グループ3;アンモニアNH3の投入→水酸化物XOHの沈殿 (塩基性状態)
- グループ4;塩基性溶液に硫化水素 H2S投入→硫化物XSの沈殿 (塩基性状態)
- グループ5;炭酸アンモニウム(NH4)2CO3の投下→XCO3の沈殿
- グループ6;余ったものは炎色反応で判別
ここで、溶液に入っている金属陽イオンを以下の図にあるものと仮定して考えていきます。
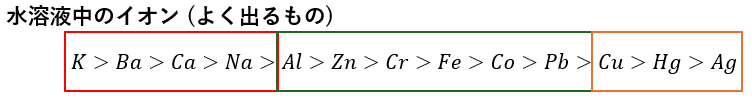
グループ①;塩酸の投入
塩酸を投入することで特定の元素の塩化物が沈殿します。
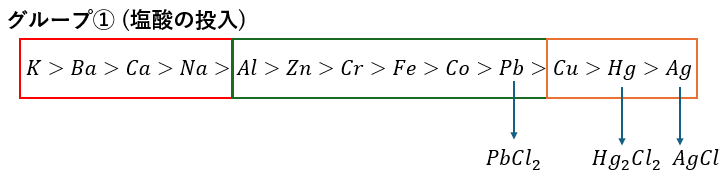
これにより、3つのイオンを特定できます。沈殿の色は全て白です。
- 塩化銀・・・アンモニアで借イオンに→再溶解
- 塩化鉛・・・熱湯で溶ける→クロム酸カリウムで黄色沈殿
グループ②;酸性でH2Sの投入
塩酸により酸性状態の溶液に硫化水素を投入します。
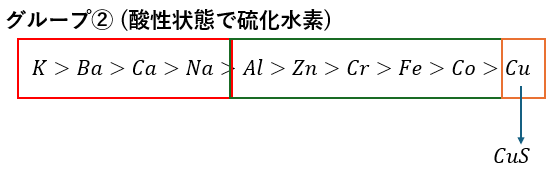
これにより、1つのイオンを特定できますが、場合によります。
- 硫化銅(黒色)・・・アンモニア水で借イオン・・・濃青色
- 硫化カドミウム(黄色)・・・カドミウムが入ってたら液性に関わらず沈殿
- 硫化鉛(黒色)・・・第一層で鉛イオンは少し溶液に残る場合がある
グループ2.5
これは陽イオンを分離する操作ではなくて単なる作業です。
何でこの作業をするのかを論述させる問題が出るので頭に入れといてください。
- 煮沸する
- 理由;残っている塩酸や硫化水素を追い出す (液性をリセット)
- もし、これらが残っていると3層の分離が4層になる
- 硝酸の投入
- 理由;硫化水素で還元された鉄を2価→3価に
- もし、鉄の2価イオンが残ってるとアンモニアで借イオンに・・・沈殿できにくい
グループ③;過剰のアンモニア水を投入
過剰のアンモニア水を投入することで水酸化物が沈殿します。
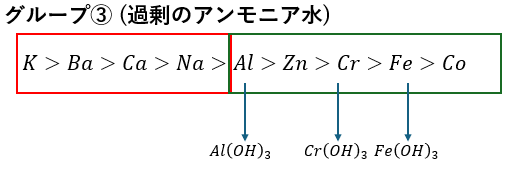
これによる沈殿の色の違いで3つのイオンが特定できて・・・
- 水酸化アルミニウム(白色)→過剰のNaOHで借イオン→溶解
- 水酸化クロム(灰色)→過剰のNaOHで借イオン→溶解
- 水酸化鉄 (赤褐色)→塩酸による中和→塩化鉄→溶解
グループ④;塩基性でH2Sの投入
アンモニアで塩基性の溶液に硫化水素を投入します。硫化物が沈殿します。
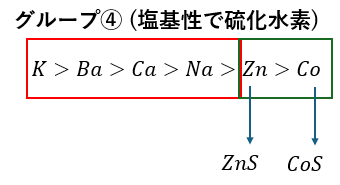
これにより2つのイオンが特定できて・・・
- 硫化鉛(白色)
- 硫化コバルト(黒色)
グループ⑤;炭酸アンモニウムの投下
煮沸することで硫化水素を追い出して炭酸アンモニウムを投入します。
これにより炭酸塩が沈殿します。
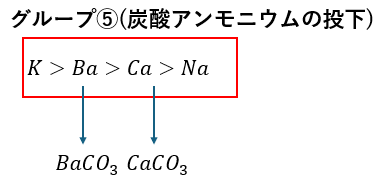
沈殿の色は全て白で・・・
- 炭酸カルシウム
- 炭酸バリウム
グループ⑥;炎色反応
ここまで来ても分離できなければ炎色反応しかありません。
ちなみに、炎色反応は覚え方があって・・・
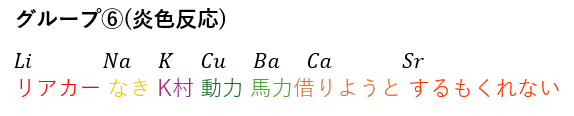



コメント