こんにちは。Horyです。
今回の記事では金属の陽イオンに関してまとめたいと思います。
今回まとめることは主に借イオンについてで、借イオンの構造や色、命名ルールをまとめたいと思います。
今回も頑張りましょう。
借イオンの表記方法
借イオンの表記方法は以下に示すとおりです。
- X・・・金属イオン (中心にある)
- Y・・・配位子 (金属イオンの周囲に展開)
- N・・・配位子の数
- M±・・・借イオンの価数
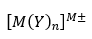
- 配位子の数と命名ルール
- 配位子の種類と命名ルール
- 命名ルールと呼び方の順番
これら3つについて個別に解説します。
配位子の数と命名ルール
配位子の数と命名ルールに関してデス。
無機化学の借イオンでは2,4,6のみ覚えておけば良いです。
- 2・・・ジ
- 4・・・テトラ
- 6・・・ヘキサ
上の言葉はギリシャ語です。
ちなみにですが、有機化学でも物質名に数字が絡む物質が出てきますが、名前の中にギリシャ語の数字が出てきます。
配位子の種類と命名ルール
配位子の種類と命名ルールです。
「配位子の種類」→「名称」という順番で説明します。

命名ルールと呼び方の順番
命名ルールと呼び方の順番についてデス。
借イオンは以下の順番で命名されます。
「配位子の数→配位子の種類→金属イオン」
この順番で読むことを忘れないでください。
金属の陽イオンと借イオンの性質について・・・
金属の陽イオンと借イオンの性質について、高校化学で頭に入れておくべきモノを解説します。
ちなみにですが、金属の陽イオンは水溶液中では水和状態で存在します。
どういうことかというと・・・
- 金属の陽イオンを水に投入
- 陽イオンのままで存在できない
- 水分子の非共有電子対が配位結合→水和状態
- 水分子よりも安定な配位子の登場→それらと優先的に結合→借イオン
紹介することに関しては色と借イオンの構造についてデス。
ここで、重要なのは色についてで、典型元素(12族も入れる)と遷移元素の違いです。
ちなみに、現在の高校化学では12族元素は遷移元素となっています。
- 典型元素(12族含む)・・・陽イオン/借イオン/沈殿に色がない
- 遷移元素・・・陽イオン/借イオン/沈殿に色がある
典型元素(12族含む)の陽イオン/借イオン/沈殿に色がないです。
色がないと言うことは無色か白色と言うことです。
典型元素の陽イオン・借イオン
典型元素(12族含む)の陽イオンと借イオンは主にZn(亜鉛)とAl(アルミニウム)です。
以下に図を用いて紹介します。
遷移元素の陽イオン・借イオン
遷移元素の陽イオンや借イオンについて解説します。
これらは色がつくモノが多いですが、例外的に色がないものもあります。
紹介するのは以下の元素のイオンです。個別に紹介します。
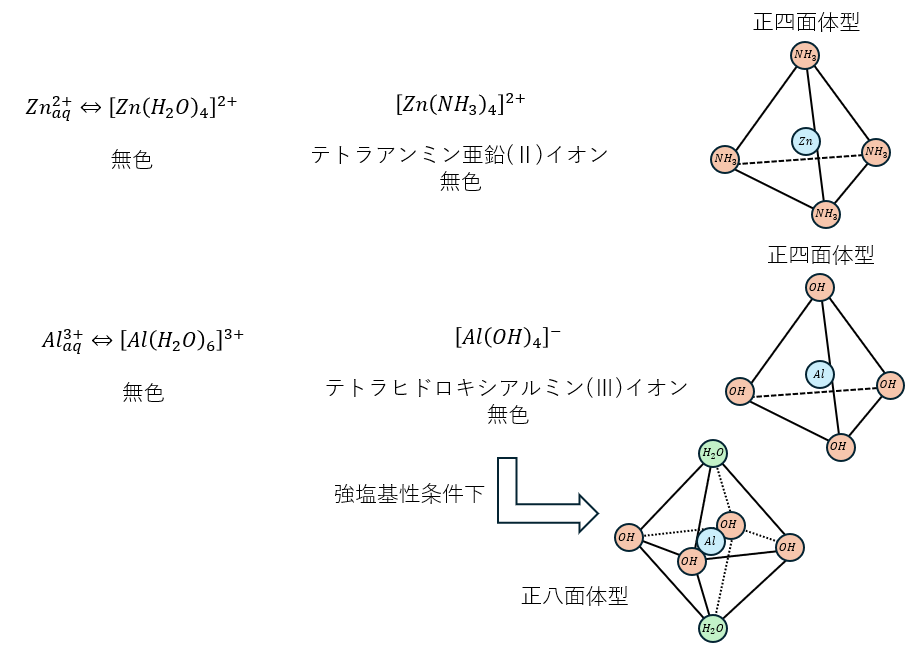
鉄イオンについて・・・
鉄には2価と3価の陽イオンが存在し、試験では頻出します。以下に紹介します。
銅イオンについて・・・
銅には1価と2価の陽イオンが存在し、これも試験で頻出します。

銀イオンについて・・・
銀は基本的に1価の陽イオンです。

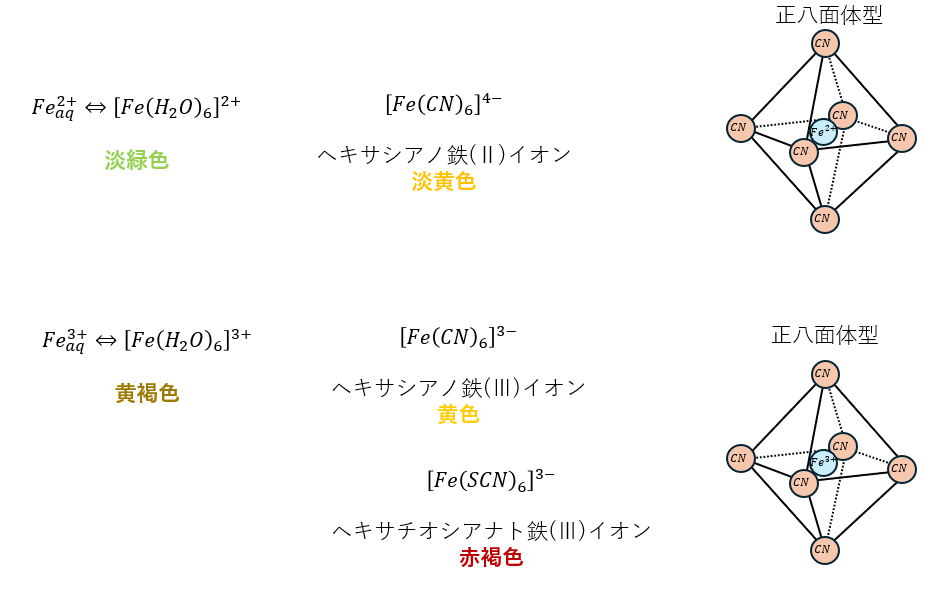
その他の覚えといた方が良いやつ
上に紹介したやつ以外でマイナーですが試験に出るモノを紹介します。

コメント