こんにちは。Horyです。
前回の記事では金属の陽イオンと借イオンの性質についてまとめました。
今回の記事では金属のイオン化傾向と沈殿についてまとめようと思います。
まとめる沈殿については3つあって・・・
- 水酸化物の沈殿 (OHが絡む)
- 酸化物の沈殿 (Oが絡む)
- 硫化物の沈殿 (Sが絡む)
これら3つの沈殿について、「水に溶けるか溶けないか」「沈殿の色」等をまとめていきたいと思います。
今回も頑張りましょう。
金属のイオン化傾向
金属のイオン化傾向とは「金属がどの程度簡単に陽イオンになるか」を数値化したモノです。
電気陰性度は「俺の電子は俺のもの、お前の電子は俺のもの」を数値化したモノで・・・
金属の電気陰性度は水素(2.1_のび太)よりも弱く簡単に電子を取られるということも話しました。
金属のイオン化傾向とは、のび太よりも弱いやつの中で序列をつけるというものです(あくまでイメージです)。
以下に金属のイオン化傾向の序列と語呂合わせ、グループを示します。

グループ①~⑤に関して個別に紹介します。
ちなみに、前回の記事で紹介しましたが、沈殿は典型元素(遷移だが12族を含む)に関しては色がないと覚えます。
グループ①について・・・
グループ①は最も陽イオンになりやすい元素の集まりです。
- 水酸化物・・・水に溶けやすいので沈殿しない
- 酸化物・・・水との反応で水酸化物に (沈殿しない)
- 硫化物・・・水に溶けやすいので沈殿しない
ちなみに、このグループは1・2族の元素の集まりなので水酸化物は強塩基性を示します。
こちらの記事で解説したことを思い出してください。
まぁ、当たり前ですが、イオンになっていたい元素の集まりなので沈殿しません。
グループ②について・・・
グループ②の元素はマグネシウム(Mg)です。
- 水酸化物・・・塩基性で沈殿 Mg(OH)2⇔白色
- 酸化物・・・水酸化物の赤熱 MgO⇔白色
- 硫化物・・・水に溶けやすいので沈殿しない
典型元素の沈殿に色はありません。
グループ③について・・・
グループ③から沈殿します。
- 水酸化物・・・水に溶けにくいので沈殿する
- 酸化物・・・水との反応で水酸化物に (水酸化物の強熱で取り出せる)
- 硫化物について・・・
- Al~Co・・・強酸性で水に溶ける/中性や塩基性で沈殿
- Ni~Cu・・・沈殿する
それぞれの沈殿と色をまとめます。
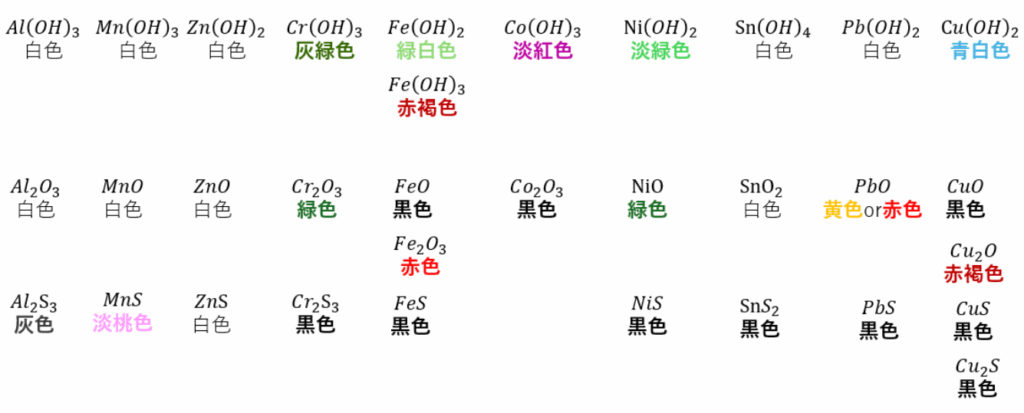
まぁ、全部を覚える必要はないと思いますが、典型元素や色がついたもの、鉄や銅は非常に大切になるので覚えてもいいかもです。
また、図に書いたものが全てではありません。
何故なら、金属は価数を容易に変えることができるからです(ここに示したものはまぁ出るだろうというものばかりです)。
そして、余談ですが、Cd(カドミウム)という元素はイオン化傾向でクロムと鉄の間にありますが、硫化物は液性に関係なく沈殿して色は黄色です。覚えておくといいです。
グループ④について・・・
- 水酸化物・・・沈殿するが見れることがない (理由は酸化物に記述)
- 酸化物・・・水酸化物に少しの熱を加えてできる
- 硫化物・・・沈殿する (液性によらずに沈殿)

基本的にこのグループの水酸化物は常温で沈殿しないと思ってもいいです。
何故なら、少しの熱で酸化物になり、酸化物として沈殿するからです。
グループ⑤について・・・
- 水酸化物・・・存在しない
- 酸化物・・・存在しない
- 硫化物・・・存在しなし


コメント