こんにちは。Horyです。
前回の記事では酸と塩基の定義に関してまとめると共に、アレニウスの定義とブレンステッドの定義の違いをまとめました。
基本的に今後の無機化学の内容は上の記事の内容を読んでおかないと理解できない物になっているので必ず読んでおいてください(記述がなければ酸・塩基の定義はアレニウス)。
今回の記事では酸性物質か塩基性物質かを判断するコツをまとめました。
ちなみに、最初に酸性物質と塩基性物質を定義すると・・・
- 酸性物質・・・水中で水素イオンを出す(酸性を示す)
- 塩基性物質・・・水中で水酸化物イオンを出す(塩基性を示す)
- 両性物質・・・酸にも塩基にも反応する
今回も重要記事となっていますので頑張りましょう。
電気陰性度 復習
皆さん、電気陰性度に関して覚えているでしょうか?
こちらの記事にも示しましたが、電気陰性度は「俺の電子は俺のもの、お前の電子は俺のもの」という思いの強さを数値化したモノです。
そして、有機化学では覚えた方が良いのが水素(H)、炭素(C)、酸素(O)ですが、無機化学では覚えてもらいたいモノがちょっと増えます。
- 無機化学の電気陰性度
- F (フッ素)・・・ジャイアンのママ (電気陰性度4.0・・・最大)
- O (酸素)・・・ジャイアン (電気陰性度3.5)
- Cl (塩素)・・・ドラえもん (電気陰性度 3.2)
- N (窒素)・・・しずかちゃん (電気陰性度 3.0)
- C (炭素)・・・スネ夫 (電気陰性度 2.5)
- H (水素)・・・のび太 (電気陰性度2.1 基準)
- 金属元素・・・のび太より弱い (電気陰性度2.1以下)
ここで重要なのは金属元素の電気陰性度はほぼ全て水素の電気陰性度2.1よりも低いと言うことです。
つまり、金属元素はのび太にすら所有物の電子を奪われると言うことです。
これを覚えておいてください。
水酸化物の酸性と塩基性
水酸化物とは、金属イオン、または非金属元素に水酸化物イオンが結合した形でできた物質です。
- 金属元素の水酸化物・・・塩基性水酸化物
- 非金属元素の水酸化物・・・酸性水酸化物 (オキソ酸)
何故、上のようになるかを個別に解説します。
金属元素の水酸化物
金属元素の水酸化物を水に溶かすとどのようになるかを考えます。
ここで、Aは金属元素であると考えます。
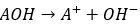
- 金属元素は電気陰性度が低い
- 電気陰性度が低いと言うことは電子を奪われやすい
- 電子を奪われて陽イオンになる
- 金属イオンと水酸化物イオンに分離
- アレニウスの定義より塩基性
だから、金属の水酸化物は塩基性を示します。
非金属元素の水酸化物
非金属元素の水酸化物を水に溶かすとどうなるかを考えます。
ここで、Bは非金属元素であるとします。
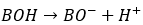
- 非金属元素は電気陰性度が水素よりでかい
- 水中で電離
- 水素イオンが放出
- アレニウスの定義より酸性
非金属元素の水酸化物はオキソ酸と呼ばれていて、無機化学と有機化学で出るもので覚え方が良いのが・・・
- 硫酸・・・無機化学
- 硝酸・・・無機化学
- リン酸・・・無機化学
- 塩素酸・・・無機化学
- カルボン酸・・・有機化学
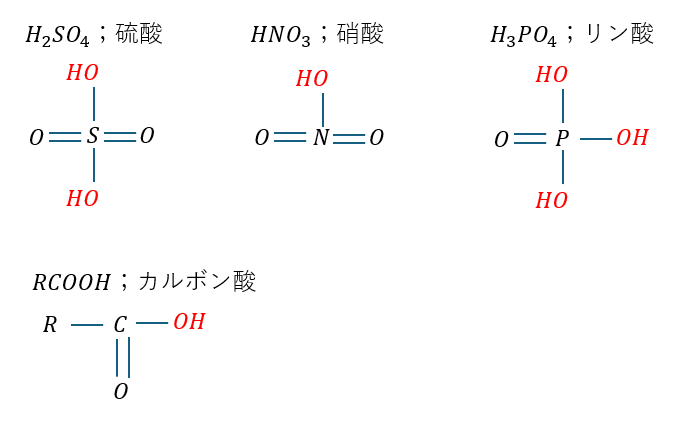
塩素酸については別の記事で示します。ところで、上に示したオキソ酸の強さの順序はどうなっているのでしょうか?・・・ちょっと考えてみてください。
ヒントは電離度(化学平衡・・・どの程度分離するか)です。今後の記事で上に示した酸の強さも非常に重要になるので頭にとどめておいてください。
酸化物の酸性・塩基性
酸化物の酸性と塩基性の判断のコツですが・・・
- 酸化物+水→水酸化物
- 酸化物は水と反応して水酸化物に・・・
- 結局は水酸化物の議論に帰着できる

酸化物にはいくつかの注意点があるのでそれをまとめます。
- CO (一酸化炭素)⇔水と反応しない⇔水酸化物出ない⇔判断不可
- NO (一酸化窒素)⇔水と反応しない⇔水酸化物出ない⇔判断不可
- 非金属元素との境界の金属元素⇔酸性・塩基性溶液にも溶ける・・・両性 (Al,Zn)
アルミニウムや亜鉛の酸化物や水酸化物は両性です。これは覚えておくと良いです。
水素化物の酸性・塩基性
水素化物の酸性・塩基性の判断のコツですが、申し訳ないですが、コツとかはないです。
愚直に覚えていくしかないですが、知っておいた方が良い物はいくつかあるので下に示すモノは覚えても良いと思います。
- 酸性水素化物・・・ハロゲンが絡むもの
- フッ化水素・・・HF
- 塩酸・・・HCl
- 臭化水素・・・HBr
- ヨウ化水素・・・HI
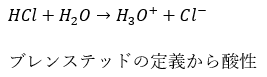
- 塩基性水素化物・・・アルカリ金属絡むもの
- LiH・・・水素化リチウム
- NaH・・・水素化ナトリウム
- KH・・・水素化カリウム
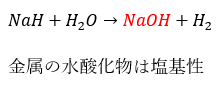
- 両性水酸化物・・・有機化学の炭化水素 (別の記事で)


コメント