こんにちは。Horyです。
前回の記事では酸化・還元の定義の変遷と酸化剤や還元剤の判定方法・酸化数のルールを簡単にまとめました。
今回の記事では酸化剤や還元剤の半反応式と原理についてまとめます。
今回も頑張りましょう。
半反応式とは・・・
半反応式とは、酸化剤や還元剤の反応を電子の動きと共に表した式です。
電子が絡むということはイオンも絡みます。だから、半反応式はイオン反応式の一種と言い換えることもできます。
化学反応が起きるときは酸化剤と還元剤の半反応式を書いて、それらを合わせる(電子を消すような細工をする)ことで化学反応式が完成するわけです。
酸化剤や還元剤はたくさんあってそれぞれに半反応式が存在します。
高校生に「これらを覚える方法はないか?」ときかれることがあって、そのたびに僕は申し訳なく「気合いで覚えるしかない」と言います。
本当に申し訳ないですが、これだけは暗記で覚えるしかありません。
ただ、原理を知っているかいないかで暗記のしやすさはだいぶ変わると思うので、この記事で暗記がしやすくなれば幸いです。
酸化剤と還元剤 半反応式
まず、前回の復習も兼ねて酸化剤と還元剤についてまとめます。
- 酸化剤・・・電子を相手からもらう (相手を酸化させ、自分は還元される)
- 還元剤・・・電子を相手から奪う (相手を還元させ、自分は酸化される)
- 電子は還元剤から酸化剤に移動する
電気陰性度が重要という話もして、
電気陰性度とは「俺の電子は俺のもの、お前の電子は俺のもの」というジャイアニズムの強さを数値化したものということも説明しました。
酸化剤と還元剤は以下のように言い換えることもできます。
- 酸化剤・・・ジャイアニズムが高い (電子を奪う)=ジャイアニズムの首謀者
- 還元剤・・・ジャイアニズムが低い (電子を奪われる)=ジャイアニズムの被害者
無機化学で覚えるべきジャイアニズムの序列も以下に示します。
- 無機化学の電気陰性度
- F (フッ素)・・・ジャイアンのママ (電気陰性度4.0・・・最大)
- O (酸素)・・・ジャイアン (電気陰性度3.5)
- Cl (塩素)・・・ドラえもん (電気陰性度 3.2)
- N (窒素)・・・しずかちゃん (電気陰性度 3.0)
- C (炭素)・・・スネ夫 (電気陰性度 2.5)
- H (水素)・・・のび太 (電気陰性度2.1 基準)
- 金属元素・・・のび太より弱い (電気陰性度2.1以下)
酸化剤と還元剤の半反応式をまとめます。
還元剤の半反応式
還元剤の半反応式をまとめます。
電気陰性度(ジャイアニズム)が低い元素が還元剤になりやすいです。
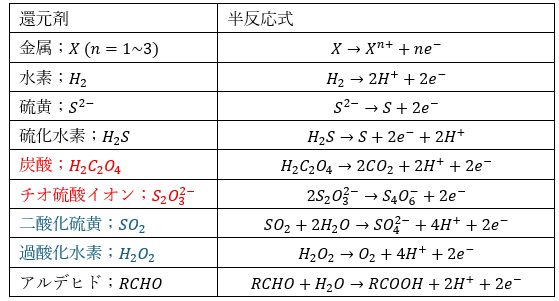
- 赤い式・・・覚えにくい式
- 青い式・・・酸化剤にも還元剤にもなる (上に示すのは還元剤で使った)
- アルデヒドは有機化学→還元性を示す(覚えておくと良い)
ちょっとした小話ですが・・・
- 炭酸イオン;還元は分裂する (構造式書くと良いかも)
- チオ硫酸イオン;2つの結合が分裂 (電子を放出→還元剤)
酸化剤の半反応式
酸化剤の半反応式をまとめます。
ジャイアニズムが比較的大きい元素の集まりです。

酸化剤は還元剤と違って厄介なモノがかなり多いです。
具体的に何が厄介かというと・・・
- 周囲環境(酸性 or 中性)で半反応式が違う
- 濃度によって半反応式が違う
多くの高校生が「ふざけんな!」と思っていることでしょう。
ただ、何故こうなっているかを考えると意外と面白さも感じると思うので、個別に解説します。
酸素の半反応式について・・・
酸素の反応について3つありますが、元素を見ていきましょう。
反応に関わる元素は以下に示す2つです。
- 酸素・・・ジャイアン (電気陰性度_3.5)
- 水素・・・のび太 (電気陰性度_2.1)
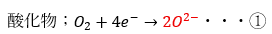
酸素イオンはジャイアンです。ジャイアンはいつも気に入らないことがあるとのび太の電子を奪いにいきます。
つまり、上の赤く示した酸素イオンは水素イオンを受け取る力が非常に強いです。
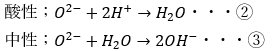
さて、①~③の反応をわかりやすい例で例えます。
- ジャイアン(酸素)の周りの電子数
- 酸素イオン・・・電子数8個
- 水の酸素・・・電子数8個
- ジャイアンが所有する所有物の数は等しい
- ジャイアン(酸素)の周りの のび太(水素)の数
- 酸素イオン・・・水素0個
- 水の酸素・・・水素2個
- ジャイアンが所有するのび太の数が等しくない
つまり、ジャイアンはジャイアンでものび太を持つ数が平等でないわけです。
だから、のび太をもたないジャイアンは「ふざけんな!」と思うわけです。
この不平等を解消する反応が起こるわけです。

覚えるなら上の式を覚えるべきですが、ジャイアンとのび太のストーリーを頭に入れておいてください。
オゾンの半反応式
これも酸素と同様にジャイアンがもつのび太が平等になるように反応が起こります。
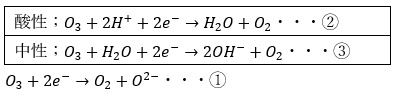
酸性と中性で不平等を解消しましょう。

酸素もオゾンも反応において出てくる酸素イオン(ジャイアン)がのび太(水素イオン)を非常に強くほしがるので、反応式では酸素イオンを消す方針で考えてください。
過マンガン酸イオンの謎
過マンガン酸イオンについて考えます。
これはマンガンと酸素によってできていますが・・・
- マンガン・・・のび太より弱い (電気陰性度_2.1以下)
- 酸素・・・ジャイアン (電気陰性度_3.5)
過マンガン酸イオンはのび太より弱いやつがジャイアン4人から電子を取られているというかなり可哀想な状況です。
そこで、この状況を見かねたのび太(水素イオン)がジャイアンを肩代わりすると言う状況です。
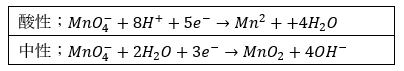
- 酸性での反応 (熱濃硫酸とか・・・)
- のび太より弱いマンガンがジャイアン(酸素)4人にいじめられている
- この状況を見かねた8人ののび太が動く
- のび太がマンガンから全てのジャイアンを払う
- マンガンイオンと水の生成
- 中性での反応
- のび太より弱いマンガンがジャイアン(酸素)4人にいじめられている
- この状況を見かねた水が動く
- のび太がマンガンから2人のジャイアンを払う
- 酸化マンガンと水酸化物イオンの生成
ちなみに、二クロム酸の反応も同じ原理です(動員されるのび太の数が14人になる)。
硫酸の半反応式の謎
硫酸の半反応式の謎ですが、反応式の横に熱濃硫酸と書きました。
これについてですが、熱濃硫酸でないとダメです(希硫酸では反応進まない)。
何故かというと・・・

濃硝酸と希硝酸も電離しているかしていないかで分類することができます。
酸化還元反応式の手順
最後に酸化還元反応式の手順をまとめます。
- 酸化還元反応かどうか・・・
- 酸化数が反応前後で変化してるか?
- どれが酸化剤でどれが還元剤か・・・
- ジャイアニズムの首謀者と被害者の判断
- 酸化剤と還元剤の半反応式を書く
- 水溶液の条件や濃度も見る
- 酸化剤と還元剤の反応式から電子を消すように細工せよ
- 半反応式を合わせて電気的に中性にせよ

コメント