こんにちは。Horyです。
これまでに酸と塩基について原理から解説しました。
ところで、酸や塩基には強弱があって強いモノを強酸・強塩基と言って、弱いモノを弱酸・弱塩基と言います。
今回の記事では酸や塩基の強弱がどのように決まるかを原理から説明します。
今回も頑張りましょう。
反応と化学平衡 復習
化学平衡に関して復習します。平衡に関してはこちらの記事でも解説していますが、念のためです。
- 可逆反応・・・右と左の反応が同時に起きている
- 不可逆反応・・・一方向のみの反応で100%進行する
可逆反応では平衡定数が定義できて、以下の反応で平衡定数Kは・・・
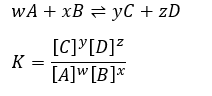
これが酸や塩基の強弱にどのように関係するのかと思いますが・・・
水溶液中に水素イオンや水酸化物イオンがどのくらいあるかが酸や塩基の強弱に関係してくるからです。
酸や塩基の強弱
酸や塩基の強弱について簡単に解説すると・・・

強酸や強塩基について、高校化学で覚えておいた方が良い物を示します。逆に、以下に示す以外の酸や塩基は全て弱酸や弱塩基と思えば良いです。
- 強酸
- 硫酸・・・H2SO4
- 塩酸・・・HCl
- 臭化水素・・・HBr
- ヨウ化水素・・・HI
- 硝酸・・・HNO3
- 過塩素酸・・・HClO4
- 強塩基
- アルカリ金属(1族)の水酸化物
- あるかり土類金属(2族)の水酸化物
ところで、同じハロゲン化水素のフッ化水素(HF)は何故、強酸ではないかというと・・・
HFは水素結合で水分子と水和しないため不可逆反応になりません(要は結合が強くて完全に電離しないと思えば良いです)。
水素結合に関してはこちらの記事に書かれています。
オキソ酸と酸性の強さ
前回の記事でオキソ酸について喋りました。
オキソ酸とは酸性の水酸化物であり、非金属元素で構成される水酸化物のことです。
これらの酸性の強さを考えてみますが、簡単のために塩素酸を例に解説します。
以下に4つの塩素酸の構造を示します。
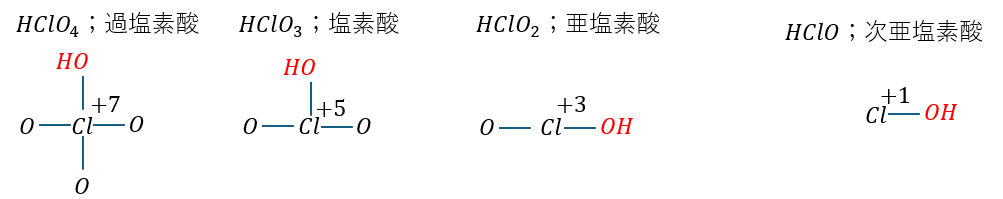
ここで、塩素と酸素についてですが・・・
- 塩素・・・ドラえもん (電気陰性度3.0)
- 酸素・・・ジャイアン(電気陰性度3.5)
塩素酸はドラえもんが複数のジャイアンから電子を奪われるという構図です。
ここで、周りにジャイアン(酸素)が多ければ多いほどドラえもん(塩素)の酸化数は大きくなります。
中心元素が同じなら中心元素の酸化数が大きければ大きいほど酸性は強いです。
何故なら、酸化数が多いと言うことは電子をたくさん取られて電子不足になります。
電子不足と言うことは電子がほしいということなので陽イオンの水素イオン(のび太)を手放したいと言う気持ちが強いです。
今回の塩素酸では過塩素酸のみが強酸で他は全て弱酸です。
ちなみに、水酸化物イオンはジャイアン(酸素)がすでにのび太(水素)の電子を奪っている状態です。
だから、ジャイアン単体(酸素単体)よりも電気陰性度が弱いと考えてください。
これめちゃくちゃ大事です。
ところで、他のオキソ酸はどうなるかを考えてみます。
強酸の硫酸・硝酸・リン酸を考えてみます。以下に構造を示します。
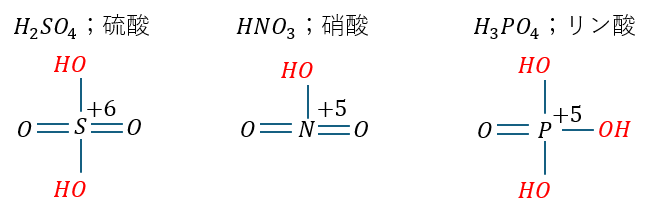
- 硫酸
- スネ夫弟(S_2.58)の酸化数+6
- スネ夫弟(S)は二人のジャイアン(O)から電子奪われる
- スネ夫弟(S)は二組の のび太・ジャイアン(OH)から電子奪われる
- 硝酸
- しずかちゃん(N_2.8)の酸化数+5
- しずかちゃん(N)は二人のジャイアン(O)から電子奪われる
- しずかちゃん(N)は一組の のび太・ジャイアン(OH)から電子奪われる
- リン酸
- のび太弟(P_2.2)の酸化数+5
- のび太弟(P_2.2)は一人のジャイアン(O)から電子奪われる
- のび太弟(P_2.2)は三組の のび太・ジャイアン(OH)から電子奪われる
電子不足のなりやすさですが・・・
硫酸(強酸)>硝酸(強酸)>リン酸(弱酸)です。
この順番は覚えた方が良いです。ちなみに、この順に電離度も小さくなっていきます。
ちなみに、もっと詳しくすると・・・
過塩素酸>硫酸>塩酸>硝酸>リン酸>酢酸>炭酸です。これも覚えても良いかもしれません。
どころで、これを見ると、中心元素の酸化数の通りに酸としての強さが並んでいませんが、電子不足の度合いというのはそう単純な話ではないのです。
例えば・・・
- ジャイアン(O)に電子を奪われる
- スネ夫(C)に電子を奪われる
- どちらが取り返しやすそうですか?
酸の強さは単純な酸化数では比較できず、どの原子と結合しているかも重要なのです。
ただ、中心元素が同じであれば、酸としての強さは酸化数で議論することができます。
まれに構造が同じモノが出てきますが、その場合は電気陰性度で決めます(例えば、酢酸とトリクロロ酢酸・・・まぁ、調べてみて)。


コメント