こんにちは。Horyです。
いよいよ無機化学の分野に入ります。
今回の記事では無機化学の入り口として酸と塩基の定義の歴史について解説します。
酸と塩基の定義は高校化学では2つ習うと思います。
- アレニウスによる酸と塩基の定義
- ブレンステッド・ローリーによる酸と塩基の定義
上の2つの人物が提唱した酸と塩基の定義を今回は解説します。
今回も頑張りましょう。
酸と塩基について・・・
酸と塩基と聞くとどういうイメージを持つでしょうか?
これについて学生に聞くと次のような答えが返ってきます。
- 酸・・・acid
- 酸っぱい (レモンとかオレンジとか・・・)
- 金属を溶かす
- 赤色のリトマス試験紙を青色にする
- 塩基 (アルカリ)・・・base
- 苦い (石けんとか)
- 青色のリトマス試験紙を赤色にする
まぁ、このような答えが返ってきます。
ところで、塩基はアルカリ性とかって言われていますが、アルカリの言葉の由来は灰です。
何で灰がアルカリ(アラビア語)の由来の言葉になっているかというと・・・
- 酸を弱める物質について・・・
- 熱する・・・灰になる
- 灰・・・二酸化炭素と何らかの物質
- 何らかの物質・・・酸の働きを弱める
- 何らかの物質をさらに熱する・・・さらに酸の働きを弱める頑丈な物質
- 頑丈=base (ギリシャ語)・・・だから塩基
これから酸と塩基の定義の歴史を解説したいと思います。
アレニウスによる酸・塩基の定義
アレニウスは酸と塩基を以下のように定義しました。
- 酸 (acid)・・・水中で水素イオンを放出する物質
- 塩基 (base)・・・水中で水酸化物イオンを放出する物質
- 中和・・・酸と塩基で反応して水と塩を生成するもの
実際に例を示します。
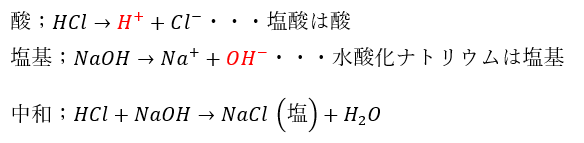
この考え方は正しいように見えますが1つ致命的な弱点を抱えています。
それは、水素の電子配置を考えれば分かるのですが、水素は電子をK殻に1つだけしか持ちません。
と言うことは、水素イオンは電子を1つも持たない陽子と同じと言うことになります。
水溶液中に普段は原子核に守られている状態の陽子がむき出しで存在することなんてできるでしょうか?・・・できるわけがありません。
考え方自体は正しそうに思えますが、この弱点を克服できなければ酸と塩基の定義をすることは難しそうです。
ブレンステッドとローリーによる酸と塩基の定義
先ほどのアレニウスの定義による酸と塩基の弱点を克服したのがブレンステッドとローリーです。
彼らは水素イオンが陽子として水中に存在できないのであれば実際はどのように存在しているのかと言うことに注目しました。
そして、水素イオンは以下のように存在すると考えたのです。
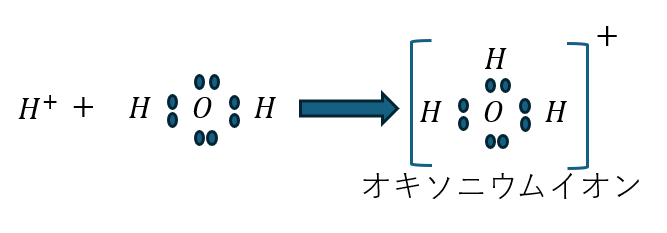
- 水素イオンが水中で存在
- 水の非共有電子対へ結合
- オキソニウムイオンになって存在
- 酸と塩基の定義は反応時の水素イオンの動きにあり
このことから、ブレンステッドとローリーは酸と塩基の定義を以下のように考えました。
- 酸;水素イオンを相手に与える物質
- 塩基;水素イオンを相手から受け取る物質
実際の中和反応で考えてみましょう。

このように、アレニウスの定義よりもブレンステッドとローリーの定義の方が酸と塩基をより広く定義できます。
結局どっちを採用するの・・・
アレニウスの定義とブレンステッドとローリーの定義どっちを採用するのかという点ですすが・・・
- アレニウスの定義・・・狭い
- ブレンステッドとローリーの定義・・・広い
今後の記事では酸と塩基について断りがないときはアレニウスの定義だと考えてください(その方が簡単だから)。
ブレンステッドとローリーの定義で考えるときはその都度記述しますので安心してください。

コメント