こんにちは。Horyです。
前回の記事で物質の状態変化と状態に関して学びました。
今回の記事では、蒸気圧とは何か?という原理を解説すると共に、皆さんがつまずくだろう液体か気体かを判断することに関して解説します。
今回も頑張りましょう。
蒸気圧について・・・
まず、密閉容器の中に液体を入れると液体は蒸発します(これは小学校で学んだと思います)。
蒸発した粒子が壁に衝突したりすることで発生する圧力のことを蒸気圧といいます。
そして、この蒸気圧には限界があります。この限界を飽和蒸気圧といいます。
例えば、蒸発する液体の量と蒸気圧を設定すると・・・

さて、ここで飽和蒸気圧に関して疑問があります。
- 蒸気圧に限度→飽和蒸気圧
- 蒸発できる液体の蒸発量molに限度
- 疑問;なんで飽和蒸気圧なの?→飽和物質量でよくね?
この疑問に対しての答えですが、物質量で考えると体積に依存してしまうからです。
一方で飽和蒸気圧は容器の体積によって常に一定です(そういう実験結果が出てる)。
仮に特定の温度での飽和蒸気圧をPaとして、もし、飽和物質量とかで考えてしまうと・・・
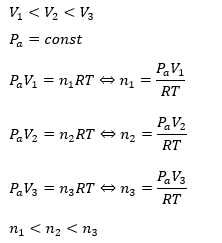
上のように飽和物質量で考えると確かに、容器の体積によりバラバラの値を取っていますね。
だから、圧力で設定する必要があるのです。
蒸気圧と気液平衡
先ほどの理由を気液平衡という側面からも伝えます(平衡に関する記事は別の記事でも書きます)。
- 気液平衡とは・・・
- 液体→蒸気(気体)になる速度
- 蒸気(気体)→液体になる速度
- 上の2つの量が一致することにより見かけ上反応が起きていないように見えること
注意してほしいのは「見かけ上」という点です。
反応が起こっていないわけではありません。見かけ上、反応が起こっていないように見えるというだけです。
Xの気体状態と液体状態をそれぞれXgax, Xliqとします。

気液平衡とは、液体から気体になる量と気体から液体になる速度が一致し見かけ上反応が起こっていないように見えることなので・・・
平衡だと濃度について以下の式が立式できます。
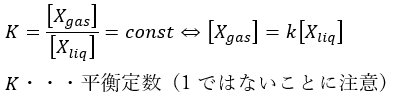
量が一致するのではありません。速度が一致するのです(別の記事で解説します)。
ここで、以下のような条件を設定します。
- 液体になるXの濃度は一定値
- 平衡定数は温度が変わらなければ一定値
- だから、気体になるXの濃度も一定値
このように考えると、気体になっているXの濃度は常に一定なので・・・
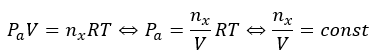
気体の物質量が平衡状態では常に一定になるので、飽和蒸気圧も一定になります。飽和蒸気圧が体積に依存しないことが証明されましたね。
蒸気圧を求める
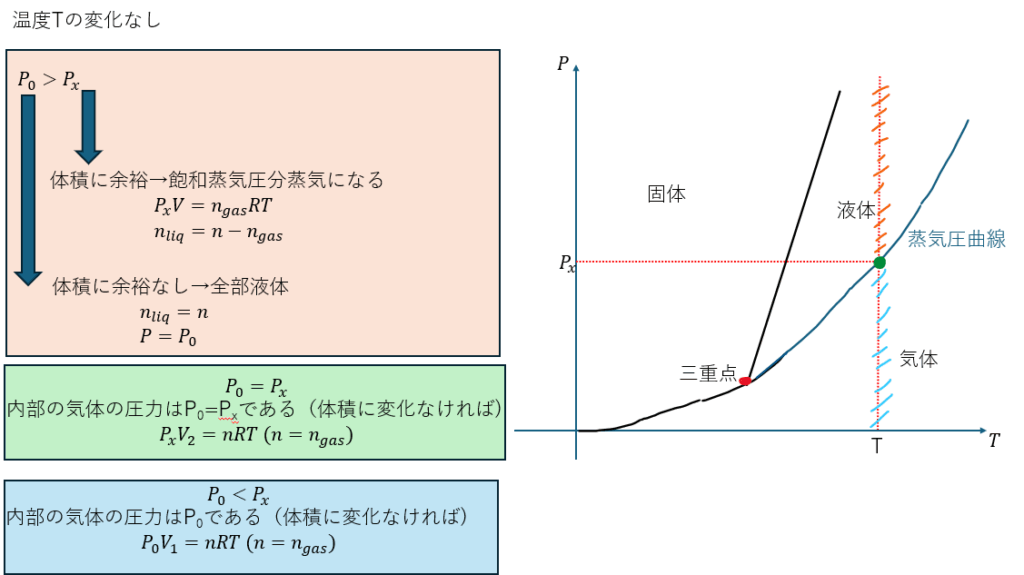
状態図を使って考えます。
状態図に関しては前回の記事でも説明したとおりですが、液体と気体の境界線を蒸気圧曲線と呼びます。
温度T[K]での蒸気圧を求めるのであれば、温度がTのときの蒸気圧曲線上の点の圧力が蒸気圧となります。

液体か気体かの判断
気体か液体かを判断する問題は皆さんが最もよく見る問題だと思いますのでそれについて解説します。
温度は一定だとします。
容器内が全て気体になっているとしたときの気体の圧力P0と蒸気の飽和蒸気圧をPxとします。
(P0に関しては状態方程式により求めれます)
まぁ、当たり前ですが、容器は壊れない非常に頑丈な容器だとします。
そして、注意ですが、P0は容器内が全て気体になっていると仮定したときの圧力です(全てが気体になるかどうかは飽和蒸気圧と比較しないと分かりません)

P0>Pxのときに安易に液体であると書いてはいけません。
どういうことかというと、容器内に飽和蒸気圧分(蒸気が存在できるだけ)の空間が残っているかどうかを判断しないといけないのです。
これめちゃくちゃ大事です。
以下でP0>Pxで容器内に体積がある場合とそうでない場合とで分けて話します。
体積がある場合
容器内に蒸気が存在できる体積が残っている場合を解説します。
このとき、液体から蒸発した蒸気の圧力は飽和蒸気圧Pxになります。
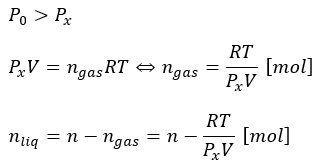
仮に、液体をn [mol]投下したとすれば蒸気の量と液体の量を求めれますね。
体積がない場合
容器内に蒸気が存在しない(蒸気が存在できる体積がない)場合についてデス。
(ピストンとかでめっちゃ圧をかけてる)
このとき、容器内は全部液体です。n [mol]投下したとすれば、n [mol]全てが液体になっています。
容器内の圧力はP0になります。
まとめ
上の説明の内容をまとめます。



コメント