こんにちは。Horyです。
今回の記事では芳香族化合物の分離に関してまとめます。これは無機化学における系統分析のようなものです。
無機化学の系統分析の記事はこちらです。
今回も頑張りましょう。
芳香族化合物と水の可溶性
疑問ですが、ベンゼン環をもつ化合物の水との相性はどうなのかと言うことですが、この記事でも書きましたが、ベンゼン自体は疎水基のため水には溶けにくいです(有機溶媒にはよく溶ける)。
ただし、ベンゼンが水に溶けにくいからといって「芳香族化合物の全てが水に溶けにくい」と考えるのは誤りです。
具体的には・・・
- ベンゼン環の置換基がイオンになるもの
- 水に溶けやすい
- 有機溶媒に溶けにくい
- 芳香族化合物で中性
- 水に溶けにくい
- 有機溶媒に溶けやすい
有機化合物の酸の強さ (お役立ち情報)
お役立ち情報と言うより絶対に覚えておいてもらいたい情報です。
酸性とは物質がどの程度水素(のび太)をイオンとして手放したいかというのを数値化したモノです。
有機化学の酸性の強さで以下は必ず覚えておいてください。
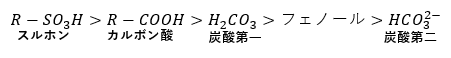
芳香族化合物の分離
芳香族化合物を分離する方法ですが抽出という方法を用います。
抽出の具体的なプロセスを以下に示します。
- 数種の芳香族化合物を分離したい・・・
- イオンに変えると水に溶ける→小細工をしてイオンにする
- 残ったモノ→有機溶媒に溶かす
- 有機溶媒に残ったモノ→再び小細工をしてイオンに
- 繰り返す
今回解説する有機化合物は以下の通りです。
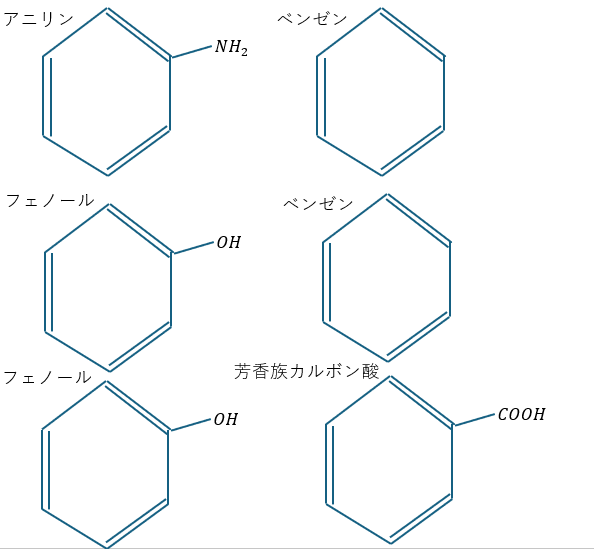
頑張ってください。今回は中性の芳香族化合物をベンゼンとします(ベンゼンだけではないよ)
具体的には以下の分離方法を解説します。
- ベンゼンとアニリンの分離
- ベンゼンとフェノールの分離
- フェノールと芳香族カルボン酸の分離
ベンゼンとアニリンの分離
ベンゼンとアニリンの分離です。
アニリンをイオンに変えます。察しのいい人は気づいていると思いますが、この記事にも書きましたよね。
以下はそのプロセスです。
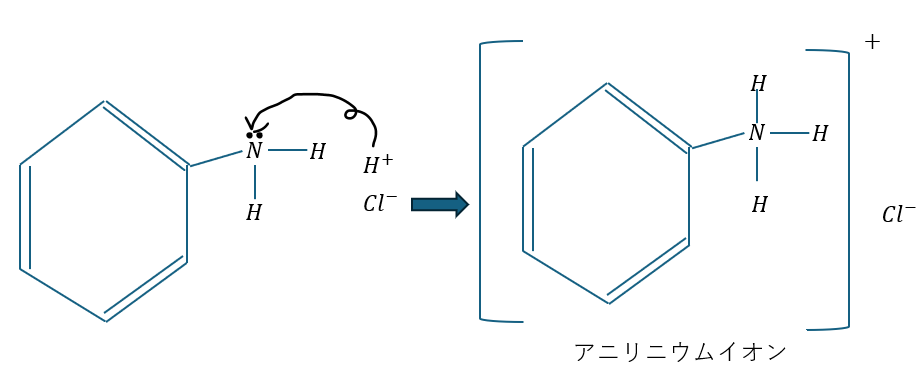
- HCl溶液(硫酸もOK)を加える
- アニリン→アニリニウムイオンに(のび太がしずかちゃんにアタック)→水層へ
- ベンゼン→イオンにならない→有機溶媒へ
- 分離成功(やったぜ!)
ベンゼンとフェノールの分離
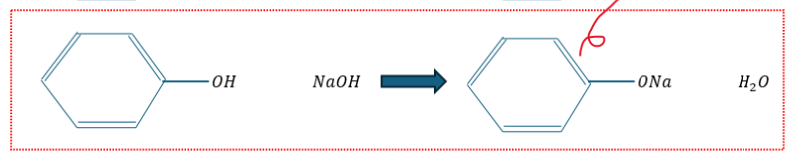
ベンゼンとフェノールの分離です。具体的にはフェノールをフェノキシドイオンにします。
以下はそのプロセスです。
- NaOH水を加える
- フェノール→フェノキシドイオンに(化学反応式ではナトリウムフェノキシド)
- ベンゼン→有機溶媒に
- 分離成功(やったぜ!)
フェノールと芳香族カルボン酸の分離
最初に、分離をしない方法だとNaHCO3水を加えるとカルボン酸は二酸化炭素を発泡します。これで分離する方法もアリです。
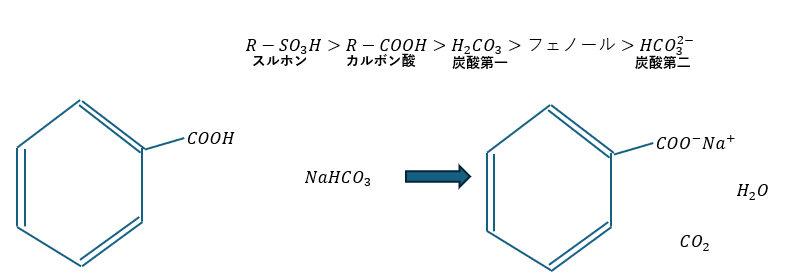
分離をしたいんであれば(どっちも水にイオンとしている)・・・
- 二酸化炭素の吹き込み
- 酸としての強さ;「フェノール」<「炭酸第一」<「カルボン」
- カルボンは電離しやすい・・・「炭酸の水素をもらいたくない」→イオンに(水層)
- フェノールは電離したくない・・・「炭酸の水素をもらう」→フェノールへ(有機溶媒)
- 分離成功(やったぜ!)



コメント