こんにちは。Horyです。
今回の記事では化学における重要事項の1つである相対原子量と原子量について説明すると共に、原子量を存在比により計算する手法をまとめます。
今回も頑張りましょう。
相対原子量
ところで、皆さんは原子1個の質量はどのくらいだと思いますか?
正解は・・・
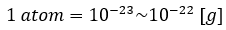
上からも分かるように非常に小さい値です。
計算の時に一々、これを代入したりすると収拾がつかなくなりますし、何より非常に面倒くさいです。
だから、質量数が12のC(炭素)の質量をちょうど12として、これを基準とします。
このように炭素を基準として他の原子の質量を決めることについて、炭素の質量を相対原子量とします。
ちなみに、相対原子量には単位はありません。
ここで、疑問が生まれます。
「何で質量数が12の炭素が基準になるのかと・・・別に質量数が16の酸素を基準にしても良いのでは?」ということに・・・
理由は質量欠損にあります。基本的に陽子と中性子が結合することでγ線が放出されます。これにより、質量数に対して相対原子量が微妙にずれてしまうのです。
酸素なら質量数16に対して相対原子量が15.99で微妙にずれる。
これについて、炭素は質量数と相対原子量がずれません。だから、炭素を基準としているのです(論説問題で出る可能性あるよ)。
原子量の導出方法
原子量はそう簡単に導出できません。
何故なら、前回の記事でも解説しましたが、同位体の存在があるからです。
つまり、原子量を求めるには、同位体の相対原子量の平均値を求める必要があります。
ここで、計算の時に意識しなければならないことをまとめます。
- 相対原子量提示されてる・・・質量欠損の考慮⇔データ用いて求める
- 相対原子量提示されてない・・・質量欠損を考慮しない⇔質量数を相対原子量に
求める時は同位体の存在比が重要になります。
存在比とは、その同位体が地球上に何%存在しているのかという値です。
試しに以下の表に示されている元素の分子量を求めてみましょう。また、本問では、質量欠損を考慮せずに質量数を相対原子量にします。
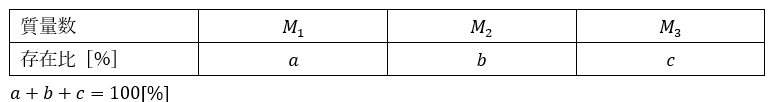
存在比が%表示されているか百分率表示されているかも重要です。今回は%表示されているので%表示の計算方法に従います。
この原子には同位体が3種類存在します。
原子量は以下の通りです。
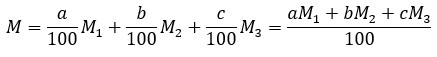
具体例として、酸素の原子量を求めてみます。質量欠損は考えずに、質量数を相対原子量にします。
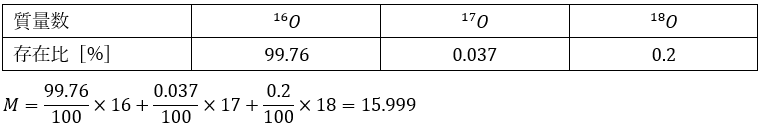



コメント