こんにちは。Horyです。
前回の記事では、相対原子量や原子量の求め方について簡単に説明しました。
今回の記事では前回の記事と関連して、物質量に関する基本的なことの説明と物質量を用いた計算のコツをまとめようと思います。
今回も頑張りましょう。
物質量について・・・
どんなに小さいモノでも集まれば大きな物になります。
原子であっても集まれば私たちがよく知る身近な値になります。
原子が6.02×10^23個集まった状態を考えます。今後はこの状態を「原子がアボガドロ数個集まった状態」といい、6.02×10^23=1×NA=1 [mol]と考えます。
この原子がアボガドロ数個集まった状態の質量は原子量(質量数)に[g]がついた値になります。

- 物質の1molあたりの質量・・・モル質量 [g/mol]
- 物質(気体)の1molあたりの体積・・・モル体積=22.4[L/mol] (0℃・1気圧)
モル体積については物質に固有の値ではなく、気体の種類がどんなモノであったとしても1molは必ず22.4Lになります。
モル計算のコツ
モル計算のコツについてデス。
化学の問題を解くとき、問題文には次のような情報が提示されます。
- ①物質の質量は・・・gである
- ②気体の体積は(常温・常圧で)・・・Lである
- ③原子の個数は・・・個である
- ④水溶液1L中・・・molある
とにかく、どのような場合であっても必ずmol(物質量)に直すことから始めてください。
これができないと化学のmol計算はできないと思ってください。
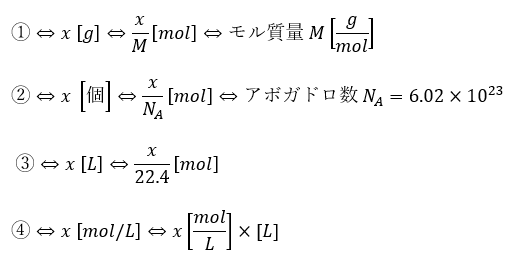
- 質量⇔モル質量
- 個数⇔アボガドロ数
- 気体の体積 [L]⇔標準体積22.4L
実際に水素1gを酸素と反応させたときに必要な酸素の量と生成する水蒸気の量を考えてみましょう。

モル計算は非常に重要なので何回も練習して絶対にできるようになってください。



コメント