こんにちは。Horyです。
皆さんはジュースとか飲みますよね。ジュースなどは水に砂糖とか色々なモノが溶けることでできています。
今回の記事では物質(溶質)が溶媒に溶ける原理について原理を解説します。
今回も頑張りましょう。
溶けるプロセスについて
そもそも、化学ではよく物質を溶かしますが、なんで溶かすのかとか考えた事ってありますか?
化学の目的の1つに異なる物質を化学反応させて別の物質(化合物)を作ることがあります。
化学反応とは「原子を組み替えること」です。つまり、固体を化学反応させたいのであれば一度原子をバラバラにさせる必要があるのです。 だから、固体の溶質を溶媒に投入して溶液にするのです。
(食塩ならNaClなので、水に入れてイオンにできる)
だから、溶液というのは化学反応になくてはならないのです。
化学反応について
- 溶質が物質1の溶液1
- 溶質が物質2の溶液2
- 物質1と物質2を混ぜる→1と2が化学反応する
ただ、注意点として溶媒は何でも無制限に溶かせるわけではありません。
- 溶かせる限度がある・・・溶解度
- 溶媒と溶質の相性がある
溶媒と溶質の相性
溶媒と溶質の相性があります。この相性に関しては「溶ける」原理をちゃんと知っていないと理解することは無理です。
そもそも溶けるとはどういうことかを解説します。
- 溶けることについて・・・
- 溶ける前・・・溶媒分子同士に分子間力が働く
- 溶質が溶けた・・・溶媒分子と溶質分子が分子間力で引き合う
- 溶質が溶けない・・・溶媒分子と溶質分子に分子間力が働かない
溶質が溶媒に溶けるとは・・・「溶質を溶媒に投入してよく混ぜたとき、溶質分子が溶媒分子の間に入って引力が働くことで溶ける前の状態にならない=溶ける」と見ることができます。
そして、相性の定義ですが、高校の化学では「溶質と溶媒分子の構造が似ている」なら相性が良くて溶けます。
具体的には・・・
- 溶質に極性・・・極性溶媒(水とか)に溶ける
- 溶質が無極性・・・無極性溶媒に溶ける
つまり、溶質分子を全体で見たときに電荷に偏りがあるかないかが非常に重要なんですね。
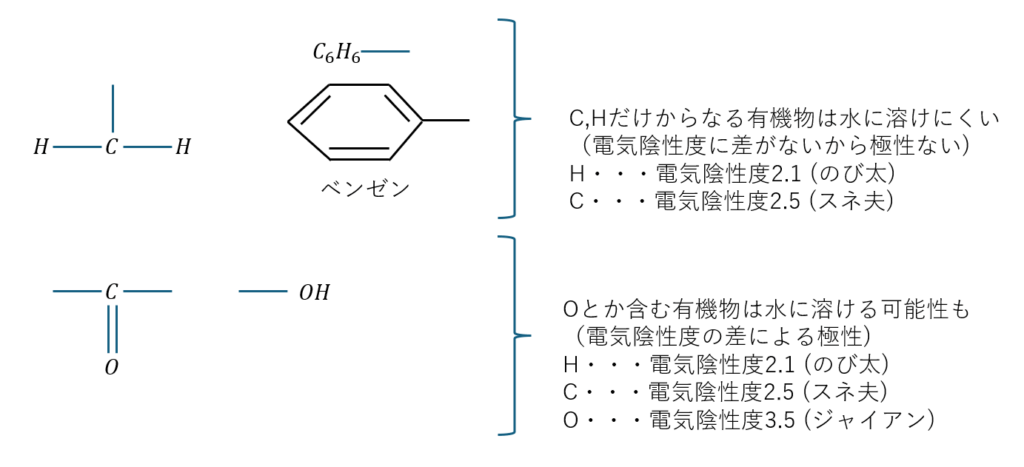
これが特に厄介なのは有機物です。
C,H,Nとかで電気陰性度にそんなに差がない(C=2.5, H=2.1, N=3)なら有機物に極性はあんまりなくて全部無極性溶媒に溶けるんじゃね?と思うかもしれませんが、それは違います。
以下に有機物の場合の図を示します。
水和について
さっきの解けるプロセスで溶質分子と溶媒分子が引き合うといいました。
だから、溶質の周りに溶媒が集まった状態になります。
- 溶質分子の周りに溶媒分子が集まる・・・溶媒和
- 溶媒和で溶媒が水・・・水和
さて、今後、溶媒にどのくらいの溶質が解けるかについて、溶解度を求めることがありますが、溶質が水和物(固体だが、水を含んでいる)の場合、計算が非常に厄介になります。
これは後々説明しますので頑張りましょう。



コメント