こんにちは。Horyです。
今回の記事では沸点上昇と凝固点降下について話します。
現在の高校化学ではこの分野の重要性が一段下がっていますが、日常生活ではよく起こることなので日常生活での応用も含めて解説します。
今回も頑張りましょう。
不揮発性について・・・
この話をする前に、まずは、不揮発性溶液について簡単に説明します。
水に塩(NaCl)とか砂糖を入れると溶液内の粒子がどうなるかを考えてみます。
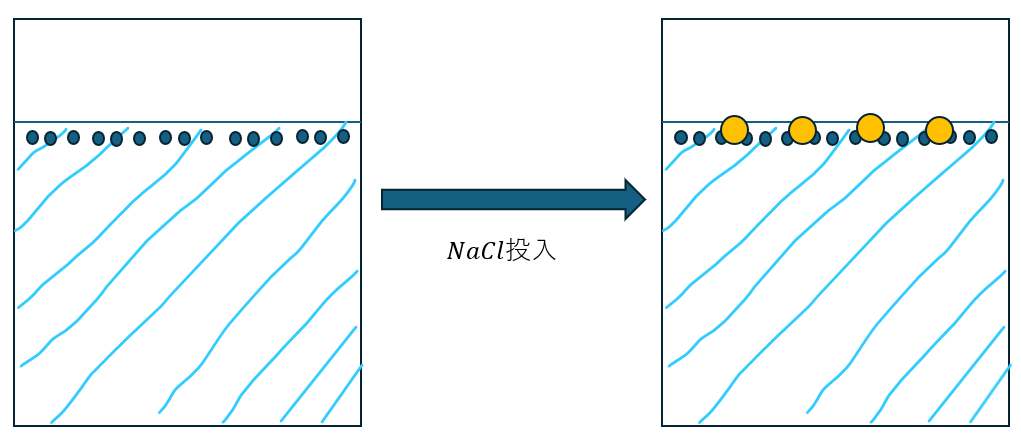
上のNaCl粒子(黄色い丸)は揮発しない(蒸発しない)と考えます。
ここで、蒸発とは「溶媒表面から一定数の粒子が蒸気になって飛び出すこと」です。
上の図に示したNaCl粒子があると溶媒粒子が表面から飛び出すのに邪魔になりますよね?
だから、水よりもジュースとか塩水の方が蒸気圧は低下して乾きにくいです(海水浴で体が乾きにくくなるのはこれのせい)。
このように不揮発性粒子によって蒸気圧が低下することを蒸気圧降下といいます。
沸点上昇について・・・
沸点上昇に関して話します。
沸騰とは「液体の温度が上昇することにより熱運動が激しくなって液体が気体に状態変化すること」です。
これは、液体→蒸気になると考えても差し支えないです。
ここで、蒸気圧降下の話を思い出してほしいですが、純溶媒に不揮発性の粒子が入ると不揮発性粒子は純溶媒粒子が蒸気として飛び出すのを妨げます。
だから、純溶媒よりも不揮発性粒子が入った溶液の方が沸点は上昇します。
これは沸点上昇と呼ばれています。
凝固点降下について・・・
凝固点降下について簡単に解説します。
ここで、以下に示す2つの反応が純溶媒と溶液でどうなっているかを考えましょう。
- 固体→液体・・・固体から液体に変化する反応
- 液体→固体・・・液体から固体に変化する反応
ここで、溶液は水に物質Xを投入したモノと考えましょう。
- 純溶媒・・・2つの反応の勢いは釣り合っている (平衡状態)
- 溶液・・・純溶媒が固体になる温度では液体から固体に変化する反応の方が弱い
以上から、溶液を固体にするには純溶媒が固体になる温度よりも低い温度で液体から固体になる粒子の数を多くする必要があります。
上のことから、溶液の方が純溶媒よりも凝固点が低くなります。これを凝固点降下といいます。
計算方法
蒸気圧降下・沸点上昇・凝固点降下の計算方法をまとめます。
- 蒸気圧降下・・・蒸気圧がΔPだけ減少
- 沸点上昇・・・純溶媒より沸点がΔTだけ上昇
- 凝固点降下・・・純溶媒より凝固点がΔTだけ低下

以上になります。重要なのは水に溶かしているという点です。
水に溶かしたら粒子がどうなるかを常に考えてください。
例えば、水にNaClを溶かしたとして、問題文にあるNaClの物質量をそのまま代入するやつがいますが、間違いです。
理由は、NaClは水に溶かすとイオンになるからです。
だから、問題文で物質を溶かすとしてその物質がイオンに分離するかしないかは常に念頭に入れておいてください。
以下に沸点上昇・凝固点降下の問題でのNaClとCaCl2のmolの計算方法を示します。
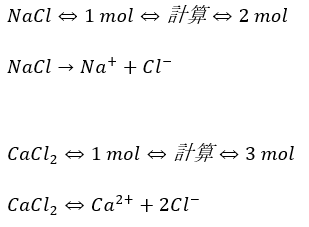
これを考えると塩化カルシウムが融雪剤として非常に優秀な理由が分かりますね。
融雪剤は水の凝固点降下を利用した仕組みです。



コメント