こんにちは。Horyです。
今回の記事では無機化学における気体の生成反応をまとめます。
化学反応式を書くときに酸化や還元についても触れるので必要なら以下の式を読んでおいた方がいいと思います。
今回も頑張りましょう。
気体の作り方
まず、高校化学で覚えるべき気体の作り方は主に3つです。
- 酸化還元反応
- 遊離反応
- 分解反応
主にこの3つです。
そして、気体を発生させるときの物質の状態の組み合わせですが・・・
- 固体と固体 (必ず加熱)
- 固体と液体 (一番多い)
上の二つの状態の組み合わせで化学反応させて気体を発生させることが非常に多いです。
ここで、疑問に思うことがあります。以下の状態で化学反応をさせることはないのかということです。
- 液体と液体
- 気体と気体
これら4つの状態に関して個別に解説します。
固体と固体の反応_○
固体と固体で化学反応を起こして気体を発生させるのであれば必ず加熱する必要があります。
何故なら・・・
化学反応とは原子の組み換えであり、粒子がバラバラにならなければ気体は絶対に発生しません。
固体と液体の反応_○
固体と液体で化学反応を起こして気体を発生させるのは最もよくあるパターンです。
反応の速度や安全性という点からも最も効率がいいです。
液体と液体の反応_×
液体と液体で化学反応させて気体を発生させるのはありそうな気がしますが、安全性の観点からあまりしません。
どういうことかというと、液体と液体で一回混ざってしまうと分離することが困難で反応を止めることができないからです。
気体と気体の反応_×
気体と気体の反応で気体を作る反応も出ないです。
ありそうと思うかもしれませんが、よく考えてみてください。
「気体+気体=気体」・・・「気体ボンベとかで初めから気体を買えばええやん」という馬鹿げた話になってしまいます。
実際にインターネットで調べても分かりますが、気体は1L~円とかで売っています。
(間違っても化学の問題で「気体の~を得る方法を答えよ」と問われたときに「インターネット通販でボンベを買う」とかってしないでくださいね(笑))
酸化還元による気体生成反応
酸化還元による気体生成反応です。押さえておくべき気体は5つです。
- 水素の発生
- 塩素の発生
- 一酸化窒素の発生
- 二酸化窒素の発生
- 二酸化硫黄の発生
この5つを頭に入れておけばいいです。正直、反応式をそのまま覚えてしまうのもいいですが、折角、酸化還元の半反応式を習得したのでそこからやります。
また、反応は全て固体と液体による反応です。
水素の発生
- 酸化剤・・・塩酸とか
- 還元剤・・・金属 (イオン化傾向がSnまでの金属)
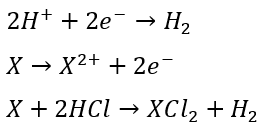
塩素の発生
- 酸化剤・・・酸化マンガン
- 還元剤・・・塩酸とか硫酸 (塩素)
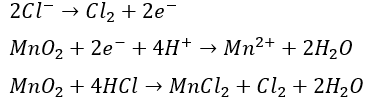
ちなみに、ちょっと考えてほしいことで、酸化マンガンよりも過マンガン酸イオンやニクロム酸イオンの方が酸化剤として強いのに何で使わないと思いますか?
考えてみてほしいです。
一酸化窒素の生成
- 酸化剤・・・希硝酸
- 還元剤・・・銅or銀
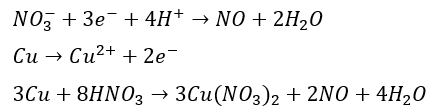
還元剤を銀としたときの化学反応式も書いてみてください。
二酸化窒素の生成
- 酸化剤・・・濃硝酸
- 還元剤・・・銅or銀
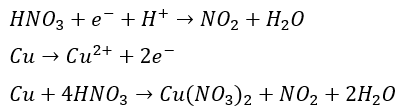
二酸化硫黄の生成
- 酸化剤・・・熱濃硫酸
- 還元剤・・・銅or銀
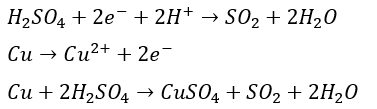
遊離反応による気体生成
有利反応による気体生成です。
前回の記事でも解説しましたが、遊離反応とは以下の反応のことです。
- 弱酸由来塩+強酸→弱酸+強酸由来の塩
- 弱塩基由来塩+強塩基→弱塩基+強塩基由来の塩
遊離反応について・・・
遊離反応で覚えなければならないのは以下の4つで・・・

また、酸化還元反応であり遊離反応でもある化学反応もあって、さらし粉と塩酸を用いて塩素を発生させる反応です。
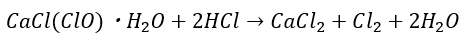
揮発性酸について・・・
揮発性酸で覚えておかなければならないのは3つで、塩酸・硝酸・フッ化水素です。

分解反応について・・・
分解とは触媒や熱(まれに勝手に分解するのもあるが)を用いて一つの化合物がバラバラのモノに分裂する反応です。
主に酸素や窒素が分解で生成します。

例外の反応
上に示した3つの反応以外で気体を生成するものを紹介します。
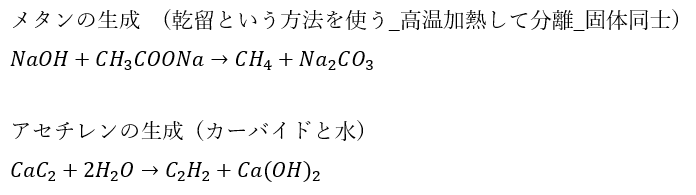


コメント