こんにちは。Horyです。
前回の記事では気体の生成方法や気体の判別方法・検出方法をまとめました。
今回の記事では実験で集めた気体をどうやって収集するか、収集の過程で実験道具を用いますが、実験道具の適切な使い方に関しても解説します。
この分野は理由を論述させる形式の問題が多いような印象を受けます。
今回も頑張りましょう。
気体の収集方法の手順
気体収集方法の手順を以下に簡単にまとめます。
- ①;適切な実験道具の準備
- ②;気体の生成 (前回の記事で話した)
- ③;生成過程で発生する不要物の除去
- ④;気体の乾燥
- ⑤;適切な方法による気体の収集
これら5つについて個別に解説していきます。
適切な実験道具の準備
試験で出るのは加熱が必要な反応(固体同士)で理由を書かせる問題とかが多いです。
- 加熱が必要な反応で水の生成
- 試験管の口を下げろ
- 何故?・・・水による急冷で試験官が割れる
例えば、以下に示す化学反応は試験管の口を下げた方がいいです。
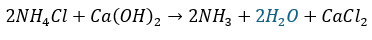
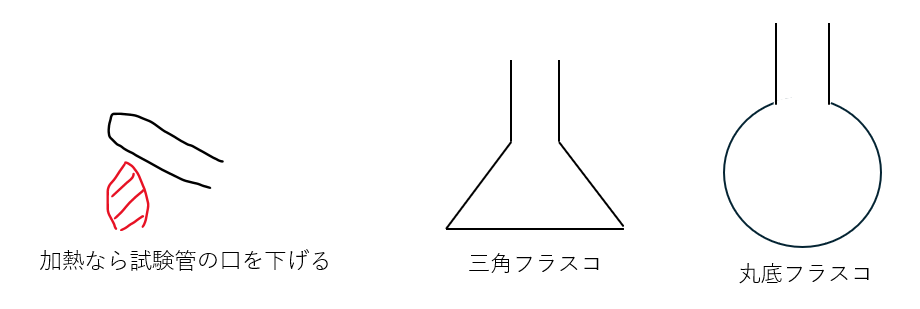
- 加熱が必要なら丸底フラスコを使用せよ
- 何故?・・・三角フラスコと比較したときの強度差
- 加熱が不要なら三角フラスコでもいいよ
分かりやすいように図を示します。
また、固体と液体による気体生成の実験装置でキップの装置は頭に入れてもいいかもです。
ここには示しませんが、かなり画期的な装置なので調べてみてほしいです。
不要物の除去
不要物の除去に関してです。
これは、今はどうか分かりませんが、私の時代では塩素の収集が有名だったので、塩素の収集を例に解説していきます。
以下に示すのは塩素を収集する際の実験装置の概略図です。
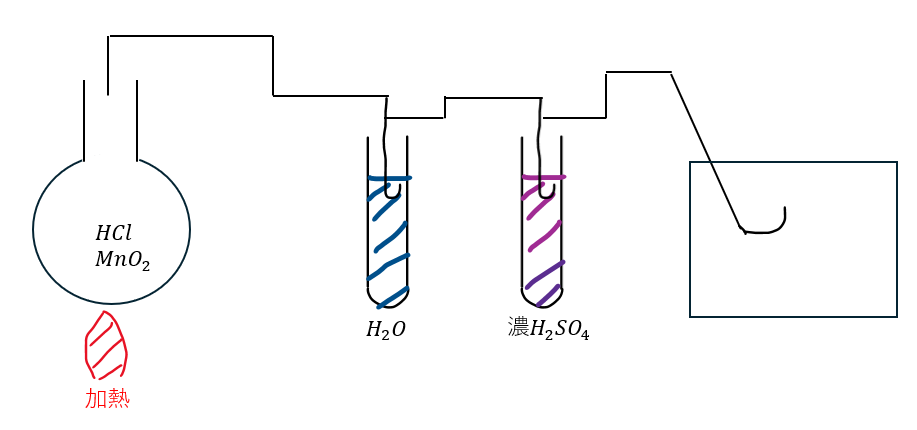
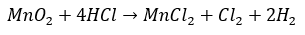
- 水がある理由
- 不要物の塩酸が残ってしまう
- 塩酸は水によく溶けることを利用して除去
- 濃硫酸がある理由
- 塩酸除去の過程で水が邪魔
- 濃硫酸の乾燥で水の除去
上のことは論述問題でよく聞かれるので覚えておいた方がいいです。
乾燥剤について
気体を乾燥させるとき、もちろんですが、適切な乾燥剤というものがあり、乾燥材にも酸性・塩基性・中性があります。
覚えておいた方がいい乾燥剤と相性が悪い気体を以下に上げます。
- 酸性乾燥剤
- 濃硫酸(H2SO4)
- 硫化水素(H2S)は乾燥ダメ・・・酸化還元反応で硫黄に
- アンモニアはダメ・・・中和の進行
- 十酸化四リン(P4O10)
- アンモニアはダメ・・・中和の進行
- 濃硫酸(H2SO4)
- 塩基性乾燥剤
- 生石灰(CaO)
- 酸性気体はダメ・・・中和の進行
- 苛性ソーダ・・・生石灰に水酸化ナトリウム混ぜたもの
- 酸性気体はダメ・・・中和の進行
- 生石灰(CaO)
- 中性乾燥剤
- 塩化カルシウム(CaCl2)
- アンモニアはダメ・・・反応してしまう
- エタノール(C2H5OH)はダメ・・・反応してしまう
- 塩化カルシウム(CaCl2)
基本的に中和が進行すると乾燥剤としては適切ではありません。
塩基性の気体で高校化学にて出るものはアンモニアだけと条件反射で覚えましょう。
また、これらの乾燥剤は化学反応の過程で水を吸収します(だから乾燥剤なのです)。
適切な方法による気体の収集
気体の収集方法は主に3つあります。
- 水上置換・・・水に溶けにくい中性気体
- 上方置換・・・塩基性気体(条件反射でアンモニア)
- 下方置換・・・酸性気体 (高校化学で出る酸性気体はほぼ全てが空気より重い)



コメント