こんにちは。Horyです。
前回の記事では弱酸や弱塩基が遊離する反応について原理をまとめました。
今回の記事では揮発性酸が生成する反応の秘密をまとめます。
原理は弱酸や弱塩基が遊離する反応と非常に似通った反応なので上の記事も見といた方が良いです。
今回も頑張りましょう。
揮発性と不揮発性
まず、揮発性と不揮発性に関してまとめると・・・
- 揮発性・・・気体になりやすいということ (蒸発しやすいということ)
- 不揮発性・・・気体になりにくいということ (蒸発しにくいということ)
高校化学で頭に入れておくべき揮発性酸と不揮発性酸は以下の通りです。
- 揮発性酸
- HF (フッ化水素)
- HCl (塩酸)
- HNO3 (硝酸)
- 不揮発性酸
- H2SO4 (濃硫酸_正確には熱濃硫酸)
これらのことを頭に入れておいてください。
揮発性酸の生成反応
揮発性酸の生成反応とは・・・
- 揮発性酸由来の塩+不揮発性酸→揮発性酸の生成
- 塩酸・硝酸・フッ化水素由来の塩に熱濃硫酸→塩酸・硝酸・フッ化水素の生成
実際に塩酸・硝酸・フッ化水素の反応を化学反応式で書いてみます。
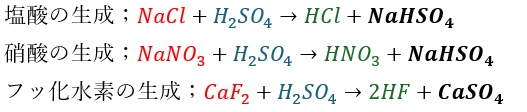
- 赤字・・・揮発性酸由来の塩
- 青字・・・熱濃硫酸
- 緑字・・・揮発性酸
- 黒字・・・硫酸塩
熱濃硫酸の秘密
揮発性酸の遊離反応を理解するためには熱濃硫酸の秘密を理解しないといけません。
熱濃硫酸はその名の通り「熱+濃硫酸」なので、当然、水をほとんど含んでいません。
だから、熱濃硫酸単体では電離しませんが、水に投入すると恐ろしく電離します。だから、電離定数もバカでかい値になります。
そして、硫酸の電離は二段階あります。
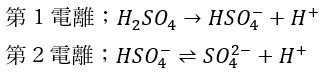
- 第1電離は・・・ほぼ不可逆反応
- 第2電離は・・・可逆反応
- 水が多量にないと電離は進行しない
また、熱濃硫酸と他の不揮発性酸電離定数の大小は以下のようになっています。
「硫酸第1」>>「塩酸」>>「硝酸」>>「硫酸第2」>>「フッ化水素」
これを考えると、硫酸の第一電離については、他の揮発性酸と比較して水素イオン(のび太)を圧倒的に手放したいと言うことです。
また、硫酸は不揮発性なので、他の揮発性酸と比較して沸点は高いです。
ここまでの内容を箇条書きでまとめます。
- 熱濃硫酸は水をほぼ含まない
- 硫酸は二段階の電離をする
- 硫酸の電離定数は揮発性酸よりでかい (水素イオンを出しやすい)
- 硫酸は揮発性酸と比較して沸点が高い
揮発性酸生成の秘密
上の説明でも分かると思いますが、揮発性酸生成反応は一種の「弱酸遊離反応」と同じです。
ただ、注意してほしいのは遊離する酸は硫酸よりも弱い酸だと言うことです。
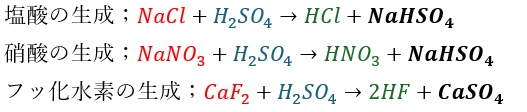
上の反応のどれを見ても揮発性酸の酸性は硫酸よりも弱く、化学反応の結果、硫酸よりも弱い酸が遊離して、硫酸の塩(強酸由来の塩)が析出しています。


コメント