こんにちは。Horyです。
前回の記事で酸や塩基についての基本的な知識や強さ、酸性物質か塩基性物質かの見分け方等を話しました。
今回の記事では弱酸・弱塩基遊離反応に関して簡単に原理をまとめたいと思います。
今回も頑張りましょう。
酸や塩基の強弱
酸と塩基の強弱は前回の記事でも話したと思いますが、復習のためにもう一度まとめます。
例え話を使った方が分かりやすいと思うので、水素イオンと水酸化物イオンを以下のように例えます。
- 水素イオン・・・のび太
- 水酸化物イオン・・・のび太&ジャイアン
- 弱酸と強酸について・・・
- 弱酸・・・水中で水素イオン(のび太)をそこまで手放したがらない
- 強酸・・・水中で水素イオン(のび太)を完全に手放す
- 弱塩基と強塩基について・・・
- 弱塩基・・・水中で水酸化物イオン(のび太&ジャイアン)そこまで手放したがらない
- 強塩基・・・水中で水酸化物イオン(のび太&ジャイアン)を完全に手放す
上の例え話が非常に大事です。
つまり、強酸や強塩基に比べて弱酸や弱塩基は水中でイオンになりたがらないと言うことです。
塩について・・・
弱酸や弱塩基遊離反応に関して解説する前に塩について説明します。
塩とは酸と塩基の中和反応で生成する物質です。
- 中和
- 酸+塩基・・・塩+水の生成
- HCl+NaOH=NaCl (塩)+水
ちなみに、塩にも種類があって・・・
- 弱酸由来の塩・・・塩を構成する元素が弱酸から来ている
- 強酸由来の塩・・・塩を構成する元素が強酸から来ている
- 弱塩基由来の塩・・・塩を構成する元素が弱塩基から来ている
- 強塩基由来の塩・・・塩を構成する元素が強塩基由来から来ている
ちなみに、これも前回の記事で示しましたが、高校で覚えるべき強酸と強塩基は以下の通りです。
これ以外は全て弱酸・弱塩基と覚えれば良いです。
- 強酸
- 硫酸・・・H2SO4
- 塩酸・・・HCl
- 臭化水素・・・HBr
- ヨウ化水素・・・HI
- 硝酸・・・HNO3
- 過塩素酸・・・HClO4
- 強塩基
- アルカリ金属(1族)の水酸化物
- あるかり土類金属(2族)の水酸化物
遊離反応について・・・
遊離反応について、以下の2つに関して個別にまとめます。
- 弱酸遊離反応
- 弱塩基遊離反応
ちなみにですが、遊離反応は中和反応ではないことに注意してください。
弱酸遊離反応
弱酸遊離反応とは以下に示す反応のことです。
- 事象・・・弱酸由来の塩に強酸を投入
- 結果・・・弱酸と強酸由来の塩が生成
- 原理・・・弱酸は強酸と比較して水素イオン (のび太)を手放したくないから積極的にのび太を取りに行って弱酸に戻ろうとする
まぁ、例を示します。
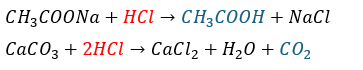
- 赤文字・・・強酸
- 青文字・・・遊離した弱酸
弱塩基遊離反応
弱塩基遊離反応とは以下に示す反応のことです。
- 事象・・・弱塩基由来の塩に強塩基を投入
- 結果・・・弱塩基と強塩基由来の塩が生成
- 原理・・・弱塩基は強塩基と比較して水酸化物イオン (のび太&ジャイアン)を手放したくないから積極的に水酸化物イオンを取りに行って弱塩基に戻ろうとする
まぁ、例を示します。
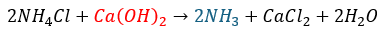
- 赤文字・・・強塩基
- 青文字・・・遊離した弱塩基


コメント