こんにちは。Horyです。
今回の記事では、原子内で働く力と原子やイオンの半径にどのような傾向があるのかについて簡単にまとめました。
今回も頑張りましょう。
原子内で働く力
まず、原子内で働く力は3つあります。
- クーロン力
- 電磁気力
- 万有引力
この中で電磁気力・万有引力は非常に小さいので無視できます。私たちは実質的にクーロン力のみ考えれば良いです。
物理の記事ではないので説明はあまりしませんが、2つの物質が電荷Q1とQ2を持つときに、2つの物質に働くクーロン力の大きさは以下のように表せます。

また、力の方向については・・・
- 2つの電荷の符号が同じ・・・反発する力 (斥力)
- 2つの電荷の符号が違う・・・引き合う力 (引力)
基本的に原子核はプラスの電荷を帯びて、電子はマイナスの電荷を帯びているのでクーロン力は引力と考えて良いです。
また、上の式で、クーロン力の大きさは距離の2乗に反比例することは覚えた方が良いです。
有効検電荷について・・・
原子がイオンになるときに大切になるのが有効検電荷です。
有効検電荷をかみ砕いて説明すると、電子と原子核で働くクーロン力を考えるとき、内核の電子と同じ数の原子核の正電荷は相殺すると考えます。
つまり、イオンになるときに重要なのは最外殻電子ということを考えて、原子核の陽子数から内殻の電子数を引き算して残った量が有効検電荷です。
例えば、酸素の有効検電荷を求めると・・・
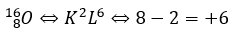
酸素の陽子数は8で、内殻の電子数は2なので有効検電荷は+6と考えれます。
ここで、有効検電荷の規則性ですが・・・
- 族が同じ(縦方向)・・・有効検電荷の数は同じ
- 周期が同じ(横方向)・・・有効検電荷の数は増える
まぁ、考えれば当たり前のことです。
そして、原子が同一族で性質が似ている理由は有効検電荷が等しいからと言うことができます(電気的な性質が似ているから)。
イオンについて・・・
イオンとは原子が「電子を失う」・「電子を与えられる」ことで原子が電荷を持ったような状態になることをイオンと言います。
イオンには種類があって。以下のように分けられます。
- 陽イオン・・・電子を失って正の電荷を持つ
- 陰イオン・・・電子を得たことで負の電荷を持つ
- 単原子イオン・・・1つの原子でイオンになっている (ナトリウムイオン)
- 多原子イオン・・・多数の原子でイオンになっている (アンモニウムイオン)
イオンは原子番号に最も近い貴ガスの電子配置になろうとします。
- 酸素(O)・・・酸素イオン⇔ネオンの電子配置(Ne)
- カリウム(K)・・・カリウムイオン⇔アルゴンの電子配置(Ar)
原子半径の傾向
まずは、典型元素の原子半径の傾向についてです(遷移元素にこのような性質はない)。
原子半径は同一族で見ると下に行けば行くほど半径は大きくなります。
何故?・・・前回の記事の表を見ていただければ分かりますが、電子は原子核の周囲をほぼ円軌道を取っているということができます。だから、下に行くほど軌道が外側になっていって広がりが大きくなるからです。
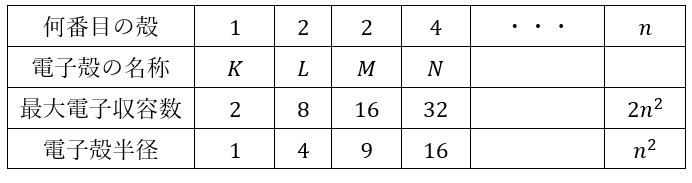
一方で原子半径は同一周期だと右に行くほど半径は小さくなります。
何故?・・・先ほどの有効検電荷の話で、同一周期では電子数が増えるほど有効検電荷の数も増えることを説明しました。
クーロン力の式を思い出してください。
電子が増えると言うことはマイナスの電気量も増えると言うことです。つまり、引き合うクーロン力の大きさが大きくなり、電子が原子核に引きつけられやすくなるので半径も小さくなります。
上の説明は論説問題で出る可能性があるので覚えておいた方が良いと思います。
ここまで説明しましたが、18族の貴ガスについては注意していただきたいです。
同一周期で貴ガスの原子半径のみ他の元素より大きいと説明があります。有効検電荷の関係上、「貴ガスの原子半径は小さくなるのでは?」と思いますが、この理由については後ほど説明します。
イオン半径の傾向
イオン半径の傾向は簡単です。
陽イオンと陰イオンで最外殻が元の元素と比較してどうなるかを考えれば良いのですから。
あくまで単原子イオンの話であることに注意してください。
- 陽イオン・・・元の原子半径より小さくなる
- 理由1・・・最外殻が1つ内側になるから
- 理由2・・・最外殻が変わらなくても電子が少なくなって反発が減るから
- 陰イオン・・・元の原子半径より大きくなる
- 理由・・・電子が増えることで電子同士の反発が大⇔電子が接近しなくなる



コメント