こんにちは。Horyです。
前回の記事までは原子半径やイオン化エネルギー・電子親和力の説明と周期性の原理を解説しました。
いよいよ、今回の記事で化学結合のプロセスに関して説明するとともに、電気陰性度に関して解説します。
今回も頑張りましょう。
化学結合のプロセス
化学結合とは、異なる原子同士でも同じ原子同士であっても、原子が結合することを化学結合といいます。
化学結合のプロセスですが、原子間(正確には電子と相手の原子核)にはクーロン力(静電気的引力)が働いていて、これが結合する原因です。
クーロン力の式についてはこちらの記事に書いてある通りです(この式は基本的に覚えた方がいいです)。
このとき、結合する原子間の距離は非常に重要なになります。というのも・・・
- 距離が近すぎる・・・反発する斥力が増加→結合しない
- 距離が遠すぎる・・・反発する斥力が増加→結合しない
つまり、化学結合が起きるには原子間の距離が近すぎても遠すぎてもいけないのです。
電子対について
原子と原子が結合するということは、原子同士が互いに持っている不対電子をシェアしあうことで共有電子対を形成することで化学結合が行われます。
酸素原子が二つ結合して酸素分子になる例を図に示します。
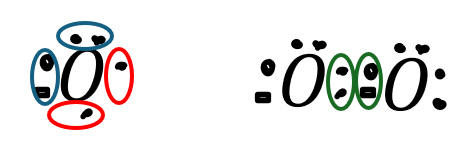
- 赤い丸・・・不対電子
- 緑の丸・・・共有電子対
- 青い丸・・・非共有電子対
酸素分子であれば互いに保有している不対電子2つをシェアして共有結合していると考えることができます。
不対電子の数は原子によって違います。そのため、結合の仕方は原子によって異なります。結合の種類に関しては次回の記事で説明します。
電気陰性度について
電気陰性度とは、原子と原子の結合において、結合中の共有電子対を引き付ける強さのことです。
電気陰性度の値が大きければ大きいほど相手の電子を引き付け陰性を示します。
電気陰性度は相手の原子中の電子をどの程度自分のモノにしたいかを数値化したものです。
電気陰性度には3つの定義があります。個別に紹介します。
定義①
電気陰性度の定義①に関して解説します。
ただし、イオン化エネルギーをEa,電子親和力をFaとします。電気陰性度をEnとすると・・・
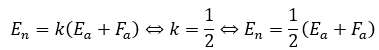
- Ea・・・イオン化エネルギーは自分の電子を引き付ける強さ
- Fa・・・電子親和力は相手の原子の電子を引き付ける強さ
- Ea+Fa・・・自分の電子と相手の電子を引き付ける強さ⇔共有電子対を引き付ける強さ
このように考えると、イオン化エネルギーと電子親和力の周期性(典型元素)に関しては前回の記事に説明したので、電気陰性度の周期性も説明できるのではないでしょうか?
定義②
電気陰性度の定義②について解説します。これは結合エネルギーによる解釈です。
基本的に「異なる原子の結合エネルギー」は「同じ原子同士の結合エネルギー」を上回ります。
今回の記事では原子Xと原子Yの結合を考えます。
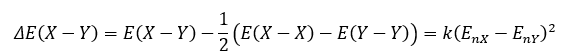
式を言葉で説明します。
上の式の意味は「異なる原子の結合エネルギーから同種の原子の結合エネルギーの差を取って2で割った量は、電気陰性度の差の二乗に比例する」という意味です。
定義③
電気陰性度の定義③に関して解説します。
これはかなりマイナーになりますが、電気陰性度を有効検電荷Zと共有結合半径rで決める方法です。
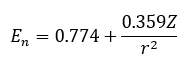
このように定義する方法がありますが、マイナーなので今回の記事では解説しません。
結局どれが正しいの?
電気陰性度に関して3つの定義を説明しましたが、結局、どれが正しいのか?についてですが、結論を先に言うと・・・
- 説明・・・定義①
- 数値・・・定義②
説明は①を用います。
イオン化エネルギーと電子親和力を同時プロットすると、イオン化エネルギーの方が極めて大きいです。だから、電気陰性度の傾向もイオン化エネルギーの傾向に似ます(希ガスは例外)。
一方で、数値に関しては②を用います。以下の3つのことは頭に入れた方がいいです。

特に、水素・炭素・酸素の電気陰性度の大小は覚えておいた方がいいです。
有機化学で大変重宝します。
僕はドラえもんで例えて次のように覚えました。
- 酸素(O)・・・ジャイアン
- 炭素(C)・・・スネ夫
- 水素(H)・・・のび太
つまり、電気陰性度が強いほどジャイアニズム(俺の電子は俺のモノ、お前の電子は俺のモノ)が強いということです。


コメント