こんにちは。Horyです。
前回の記事では化学平衡に関して基本的な原理を解説しました。
今回の記事では化学平衡の向きとル・シャトリエの原理について解説します。
ル・シャトリエの原理は化学平衡の向きに関する重要な原理の1つで頻出する分野です。
今回も頑張りましょう。
平衡定数と化学平衡の向き
化学反応「xA+yB⇌zC」を考えます。平衡定数は以下のように書けます。
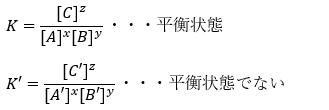
上の式で導出できるKは平衡状態における平衡定数であると考えます。
ところで、平衡状態でないときの値をK’とします。平衡状態でないということは、化学反応が正反応か逆反応のいずれかに偏っていると言うことです。
どちらに偏っているか知りたいのであれば、平固定数KとK’の大小を比較すれば良いのではないでしょうか?
ちなみにですが、[A]と[A’]というのはどちらも物質Aについてですが、濃度が違うと言うことを表していると考えてください。もちろん、温度は一定とします。
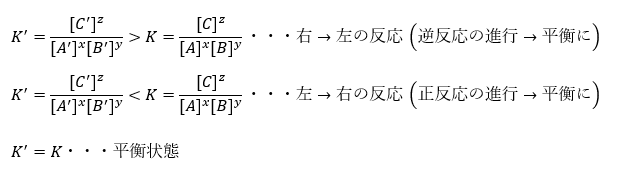
平衡計算の手順
平衡計算の手順についてデス。
これも非常に重要なので必ず以下のように示してください(数学の微分でグラフを描くときの増減表みたいなモノなので必ず書いてください)。
以下のことは表にして必ず示さなければなりません。
- 反応物と生成物の化学式
- 化学反応式
- 最初のモル濃度 [mol/L]
- 変化したモル濃度 [mol/L]
- 平衡時のモル濃度 [mol/L]
これら5つの事項を表にします。
ただし、最初の状態で左→右(正反応に偏っている)で平衡状態ではないとして、右→左にどの程度移動すると平衡状態になるか?をテーマとしています。
問題を解くときは最初に以下のことを意識しなければなりません。
- 最初の時点で反応が左→右に偏っていて平衡でない
- 正反応に反応が偏っている
- 右→左にどの程度移動すると平衡
- 立式する
- 最初の時点で反応が右→左に偏っていて平衡でない
- 逆反応に反応が偏っている
- 左→右にどの程度移動すると平衡
- 立式する

ちなみに、最初の状態でABが生成されていない(AB=0)場合が結構あってその時は・・・

ル・シャトリエの原理とは、、、
ル・シャトリエ原理とは
「平衡状態の化学反応について、周囲環境に何らかの変化を起こすと、変化を妨げる向きに反応が進行して新しい平衡状態に移動する」という原理のことです。
周囲環境の変化とは具体的には以下のような反応のことです。
- 圧力の増減
- 温度の増減
- 濃度の増減
これらについて個別に解説します。
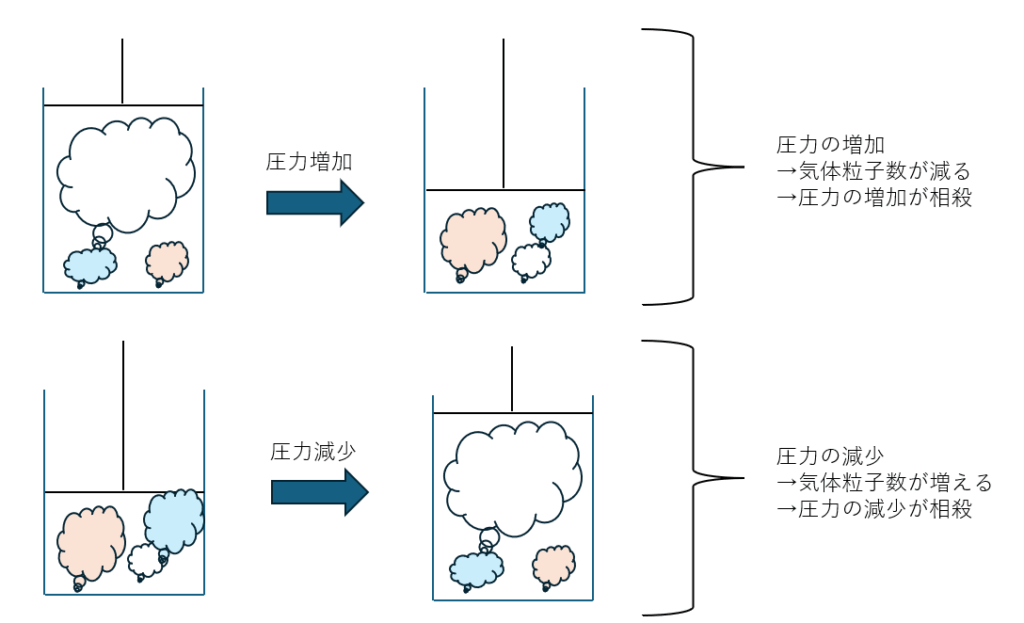
圧力の増減
圧力の増減についてですが、以下のことが成立します。
- 圧力の増加・・・気体の体積が減少する方向へ (粒子数=molが減少する方へ)
- 圧力の減少・・・気体の体積が増加する方向へ (粒子数が増加する方へ)
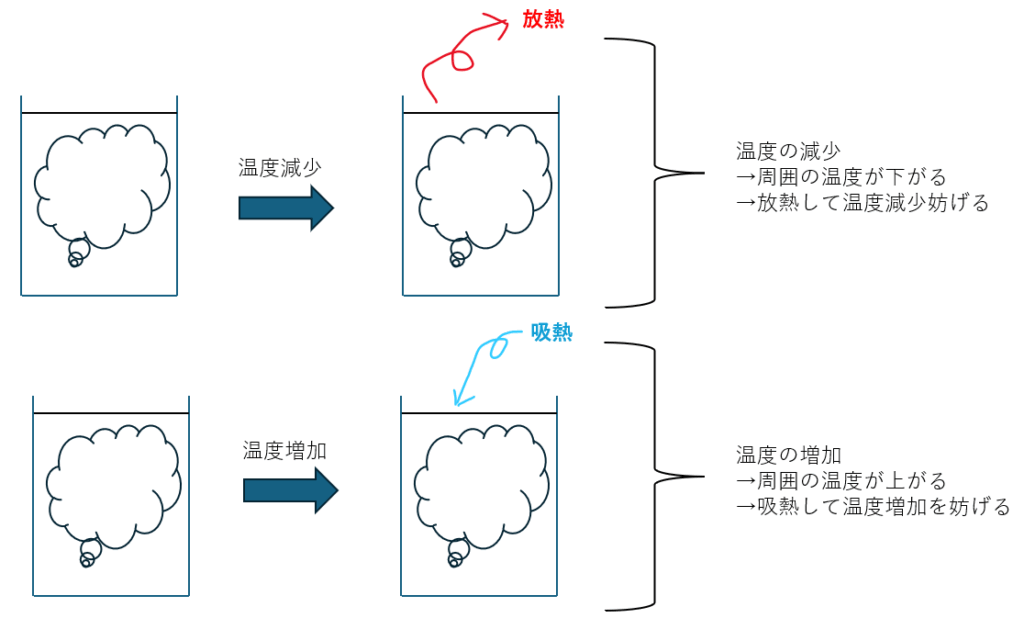
温度の増減
温度の増減に関してですが、以下のことが成立します。
- 温度の増加(加熱)・・・熱を吸収する方向へ (吸熱)
- 温度の減少(冷却)・・・熱を放出する方向へ (発熱)
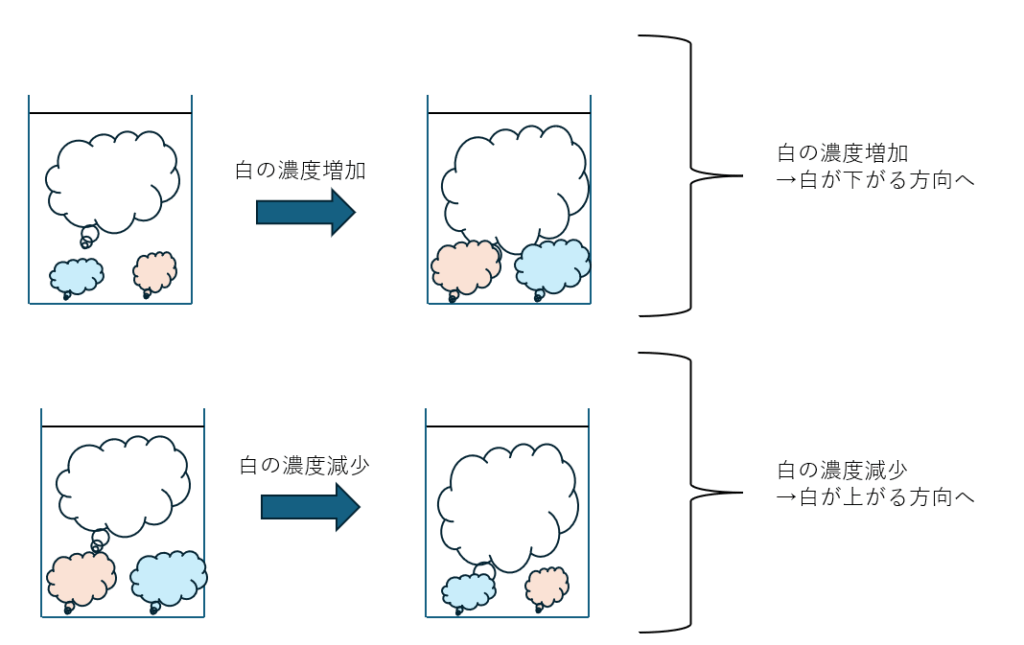
濃度の増減
濃度の増減については以下のことが成立します。
- 特定物質の濃度を増加・・・特定物質の濃度を下げる方向へ
- 特定物質の濃度を減少・・・特定物質の濃度を上げる方向へ
注意点
ル・シャトリエの原理を考えるときは以下の注意点があります。
- 化学反応式に固体・・・固体濃度は一定→平衡移動に関与しない
- 触媒の存在・・・活性化エネルギーを下げ反応速度上げる→平衡移動に関与しない
これらのことは意識しておいた方が良いです。
ル・シャトリエの原理 問題の攻略
ル・シャトリエの原理に関する問題を紹介します。

この問題を例に解説します。
重要なのは(d)と(e)です。この違いを理解しておかないとル・シャトリエの原理を理解したとは言えません。
この問題で重要なのは気体のモル濃度です。固体のAは平衡に関与しないです。
気体の粒子数が多いのは右辺です。
(a)解答・解説
- 全圧を減少
- 圧力の減少に反応して容器の体積が増加 (ボイルの法則)
- 圧力減少を妨げる向きに移動
- 気体粒子の数を増加する方向に
- 平衡は右に移動
(b) 解答・解説
- 体積を増加
- 体積の増加に反応して容器の圧力が減少(ボイルの法則)
- 圧力減少を妨げる向きに移動
- 気体粒子の数を増加する方向に
- 平衡は右に移動
(c)解答・解説
- 圧力一定で固体のAを投入
- 固体の濃度は一定と見なす
- 固体は平衡移動に関与しない
- 平衡は移動しない
(d)解答・解説
この問題に関しては図を用いて解説します。体積を一定にすると言うのがポイントです。
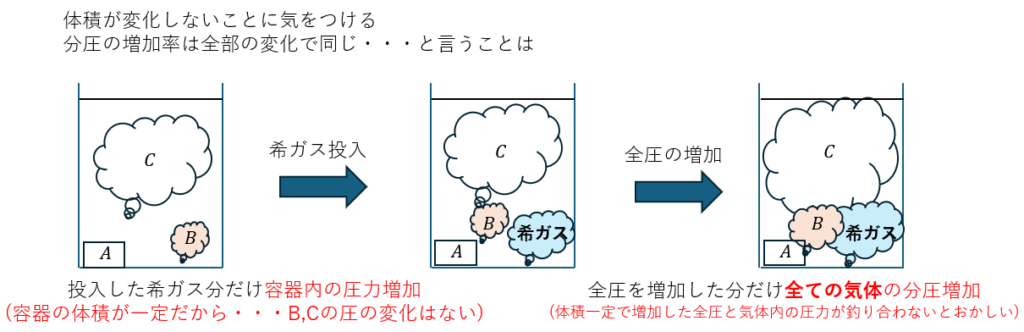
この反応で平衡は移動しません。
(e)解答・解説
この問題も図を用います。全圧を一定にしている事がポイントです。
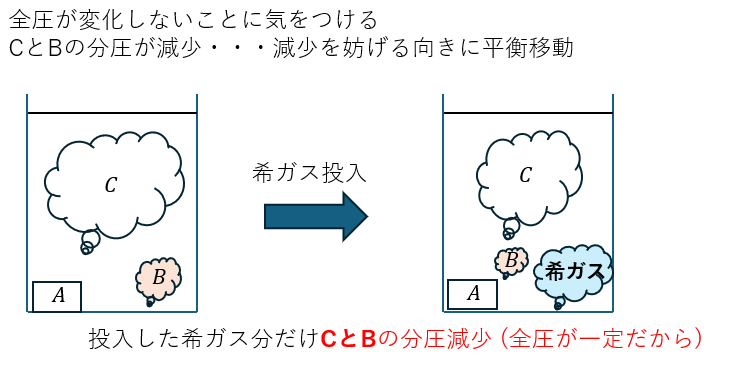
平衡は右に移動します(粒子数が増える方向)。


コメント