こんにちは。Horyです。
高校化学の最初の記事として、原子発見と原子構造解明の経緯に関して簡単にまとめます。
今回も頑張りましょう。
原子発見までの経緯
原子発見までの経緯を以下のカテゴリーに分けて解説します。
- 質量保存の法則
- 定比例の法則
- 原子説と倍数比例の法則
- 気体反応の法則
- 分子説
質量保存の法則
中学校で習ったと思いますが質量保存の法則です。
中学校の理科の授業で習ったと思いますが念のために復習しておきます。
1789年にラボアジェが発見した法則で内容は「化学反応の前後で元素の種類と質量は変化しない」という法則です。
発見の経緯は完全に密閉された容器で化学反応を起こしたところ反応前後で質量が変化しなかったことから証明されました。
そのことを式にまとめると・・・
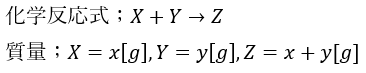
定比例の法則
1799年にプルーストにより発見された法則で「化学反応前後で反応についての物質の質量の割合が一定になる」という法則です。
そのことを式にまとめると・・・
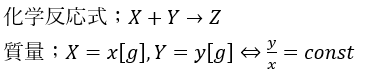
原子説と倍数比例の法則
1803,04年にドルトンによって発見されました。
非常に重要な法則です。有名ですが、一応、復習しておきます。
この2つの法則が質量保存則・定比例則を裏付けることにもなりました。
原子説
原子説です。「中学校では物質は原子からできている」というふうに習っていると思いますが、それだけではありません(物質の最小単位が原子という説は昔からあった)。
以下に原子説をまとめます。
- 物質の最小単位は原子である(分割はできない)
- 同一元素の原子の性質(特徴)は同じ
- 異なる原子が一定比で結びつくことで化合物ができる
- 原子の結合の組合わせの変化が化学反応
- 原子は何もないところから生成することも消滅することもしない。
質量保存則・定比例則が裏付けられる理由ですが・・・原子XとYが1:1で結合するとします。
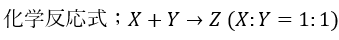
また、反応の前後を以下の図に示します。
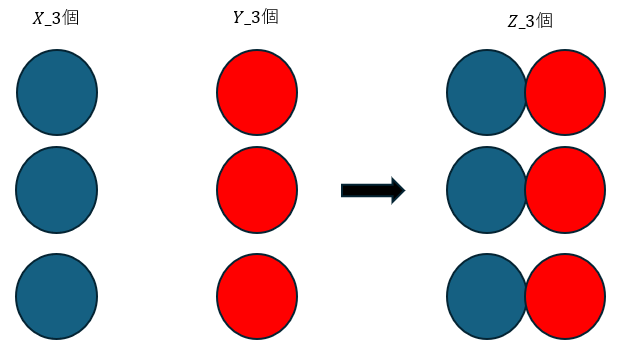
上の図ではXとYがそれぞれ3個ずつの反応を示していますが、図から、質量保存の法則が成立するのは当たり前です。
XとYの原子の質量をWxとWyとおきます。
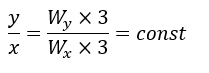
上の例ではXとYが3個ずつ反応することを挙げていますが、これが任意の数でも成立することは感覚的にも分かると思います。
よって、定比例則も成立していますね。
倍数比例の法則
化合物は原子が1:1で成立するモノばかりではありません。
2:1で結合するモノもあります。
そのような場合でも質量比が簡単な整数比になるかどうかを調べます。
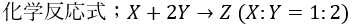
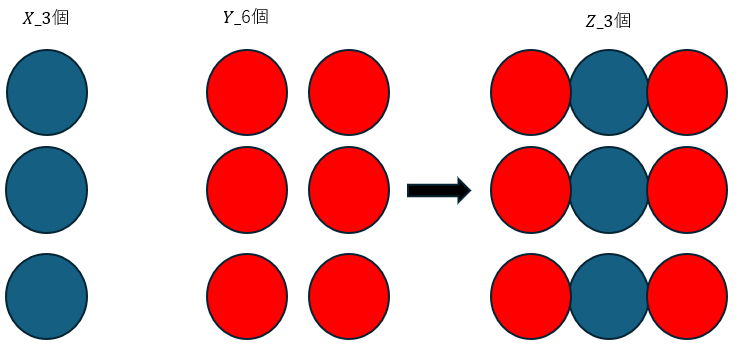
XとYの原子の質量をWxとWyとおきます。
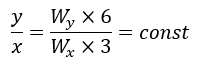
上の例ではXが3個、Yが6個でZが3個できることを示しています。
Xの質量についてYの質量比が倍数的になっているので倍数比例則と呼びます。
気体反応の法則
1808年にゲイリュサックが発見した法則が気体反応の法則です。
これは、「同温・同圧で2種以上の気体が化学反応したとき、体積が簡単な整数比になる」ということです。
ここで、簡単な例として気体水素と酸素が反応して水蒸気ができる反応を書いてみます。
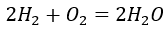
確かに、水素、酸素、水蒸気の体積比が2:1:2になっています。
ここで気づいた人がいるかもしれませんが、「あれっ?」って思います。
気体反応則によるドルトンの説の不整合
ゲイリュサックの気体反応則にドルトンの説を当てはめると説明できないことが起こります。
水素と酸素で水ができる例を用いて解説します。
- 水素原子と酸素原子が1:1で反応
- 水素原子と酸素原子が1:2で反応
原子説の異なる原子が1:1で反応することを前提として化学反応式を図に示します。
当然、体積比も1:1で反応します。
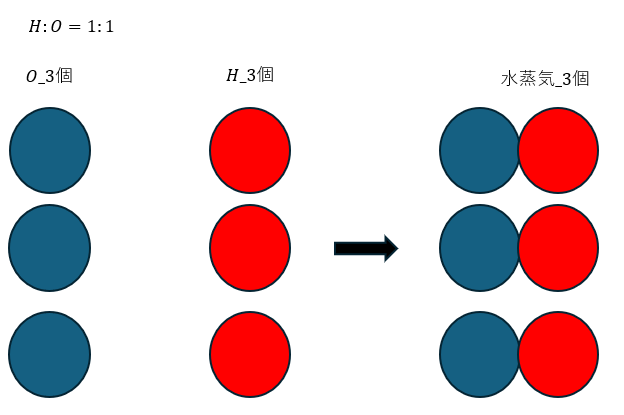
上の図から、体積比1:1の水素原子と酸素原子で水蒸気ができますが、水蒸気の比率は1です。
ただ、気体反応の法則では水蒸気の体積は2になるはずです。なので、不整合な結果になります。
今度は水素原子と酸素原子が2:1で反応することを前提として化学反応式を図に示します。
当然、体積比も2:1で反応します。
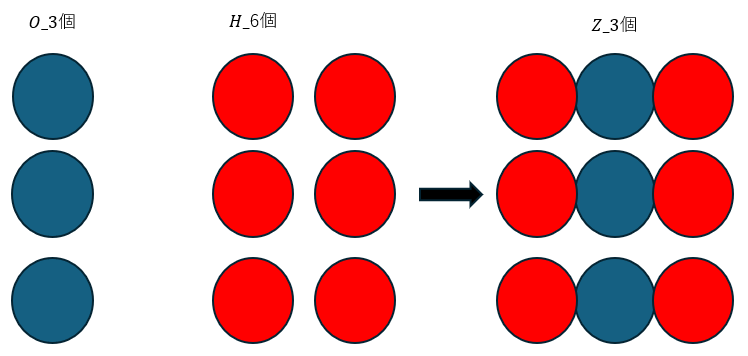
上の図から、体積比2:1の水素原子と酸素原子で水蒸気ができますが、水蒸気の比率は1です。
ただ、気体反応の法則では水蒸気の体積は2になるはずです。なので、不整合な結果になります。
ドルトンの説は正しい部分もありますが、気体反応則を考えた場合、矛盾があります。
ちなみに、気体反応則は実験によって得られた結果なので正しいと言わざるを得ません。
ドルトンの法則に何かしらの改良を加える必要があります。
分子説とアボガドロの法則
1811年にアボガドロによって提唱されました。
これも非常に重要な法則です。
ドルトンの説と気体反応則で整合性がとれるようになりました。
分子説
分子説は「気体が同種の原子が2つ結合した分子からなる」という説です。
これにより、ドルトンの原子説が気体反応則と矛盾しなくなりました。
水素と酸素が反応して水蒸気が生成する例を示して解説します。注意しなければならないのは水素と酸素が分子で存在することです。
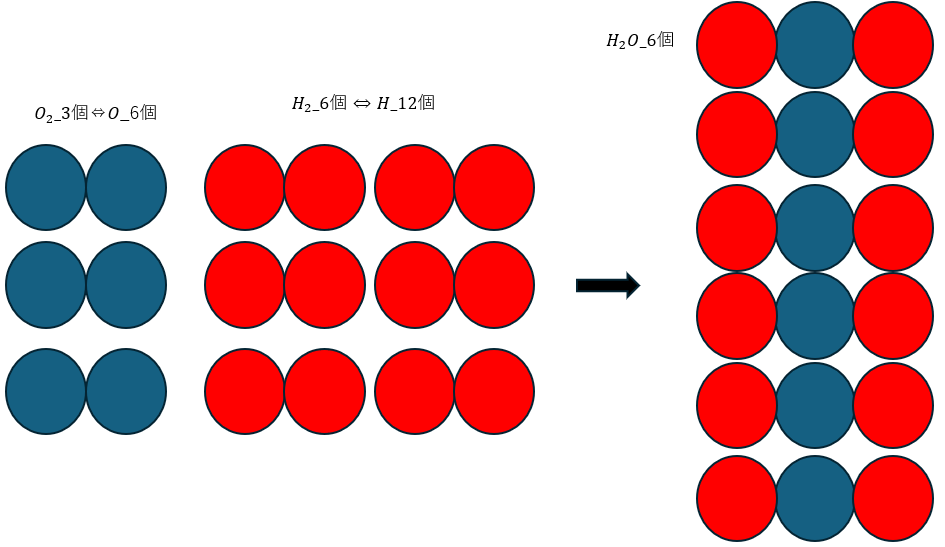
このように考えると水素分子と酸素分子が2:1で反応します。
だから水素・酸素・水蒸気の体積比も2:1:2になるので気体反応則とも矛盾しません。
アボガドロの法則
最後にアボガドロの法則ですが、「同温・動圧で気体は種類によらず、同体積に同数の分子が含まれます」。これは化合物であったとしても言うことができます(原子ではなく分子デあることに注意です)。
標準状態(0℃=273K・大気圧)で気体の種類によらず、22.4lにアボガドロ数の粒子が含まれます。
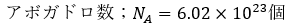
まとめ
最後にまとめです。
原子発見の経緯なんて試験でほとんど出ません。
「こんなことやって何の意味があるのか?」と思うかもしれませんが、私たちは「原子や化学反応を目で見たことがあるでしょうか?」
目で見ることができないモノを議論するときにそれらが発見された経緯や構造解明の経緯をすっ飛ばして原子や化学反応に関する授業をすることに違和感を感じます。



コメント