こんにちは。Horyです。
前回の記事で化学結合に関して簡単に解説し、その中で共有結合に関する話をしました。
そこで、共有結合で形成される結晶の中に分子結晶というモノがあるという話もしました。
今回の記事では、前回の記事の復習も兼ねて、分子結晶に関して性質をおさらいすると共に、分子の構造(形)と極性に関して原理と本質から解説しようと思います。
今回も頑張りましょう。
分子結晶の性質
分子結晶とは分子が分子間力という比較的に弱い力で結合して結晶化したモノを言います。
勘違いしないでほしいのが分子自体は共有結合で結合していることです。
以下に示すのは分子結晶の性質です。
- 分子間力は弱い力
- 結晶は柔らかく強度も低い
- 温度によって簡単に切れるので融点や沸点は低い
- 電気を流さない
以上が分子結晶の性質になります。ここまでは前回の復習です。
分子の構造(形)について・・・
分子の構造に関してです。これも暗記をする学生が非常に多く、それが悪いとは言いませんが、原理を説明できる人は少ないと思います。
そもそも、分子は原子が化学結合することによってできますが、化学結合には必ず電子が絡みます。
そして、分子中の電子は同一の電荷を持ち互いに反発します。
原子が分子を構成するときはこの反発が最も小さくなるような構造(形)を取ります。これを電子反発則と言います。
ここで、反発が最も小さい形というのは電子対の方向の数に依存します。
- 2方向・・・直線型
- 3方向・・・正三角形型・折れ線型
- 4方向・・・正四面体型・正三角錐型・折れ線型
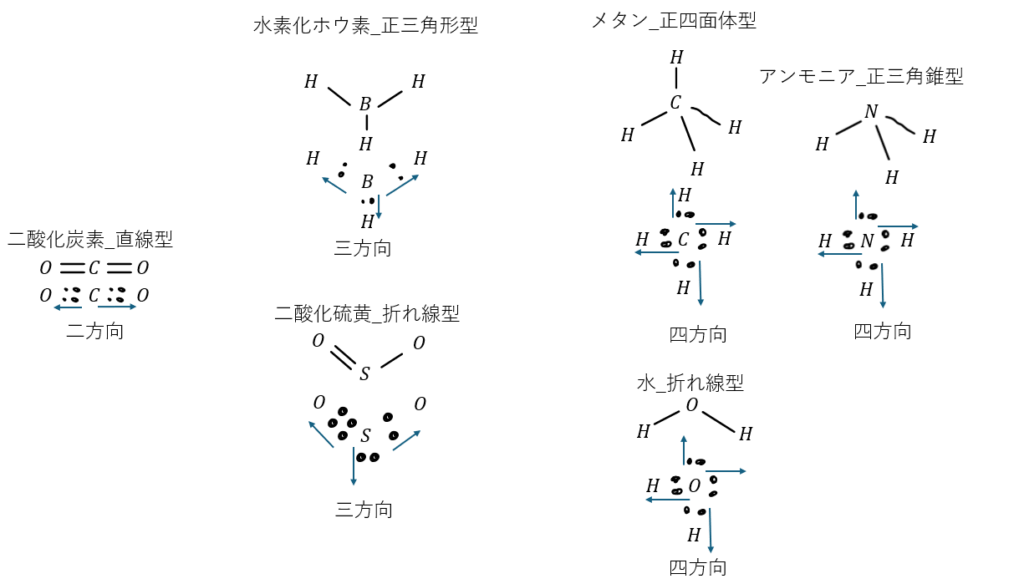
分子と極性について
分子と極性に関して解説します。
前回の記事で電気陰性度について話しましたが、これは、各原子について「俺の電子は俺のもの、お前の電子は俺のもの」という気持ちの強さを数値化したものというイメージです。
極性というのは2つの異なる原子について、電気陰性度に差があって生じます。
- 正電荷と負電荷の重心一致しない→極性分子
- 正電荷と負電荷の重心一致→無極性分子
- 二原子分子で電気陰性度に差がある→必ず極性分子
- 三原子以上の分子で対称性あり→重心の一致→無極性分子
- 正三角形型
- 正四面体型
- 直線型で対称的なもの
ただし、同じ極性分子であっても極性の大きさに差はあります。
先ほどの例で示した分子を極性分子と無極性分子で分けると・・・
- 極性分子
- 二酸化硫黄
- アンモニア
- 水
- 無極性分子
- 二酸化炭素
- 水素化ホウ素
- メタン



コメント