こんにちは。Horyです。
前回の記事ではベンゼンの反応の仕組みとラジカル付加反応でシクロヘキサン等ができる反応を紹介しました。
ベンゼンの反応の中で基本になるのは求電子置換反応です。
今回の記事では求電子置換反応の原理を解説すると共にベンゼンのクロロ化とアルキル化、アセチル化を解説します。
今回も頑張りましょう。
求電子置換反応の原理
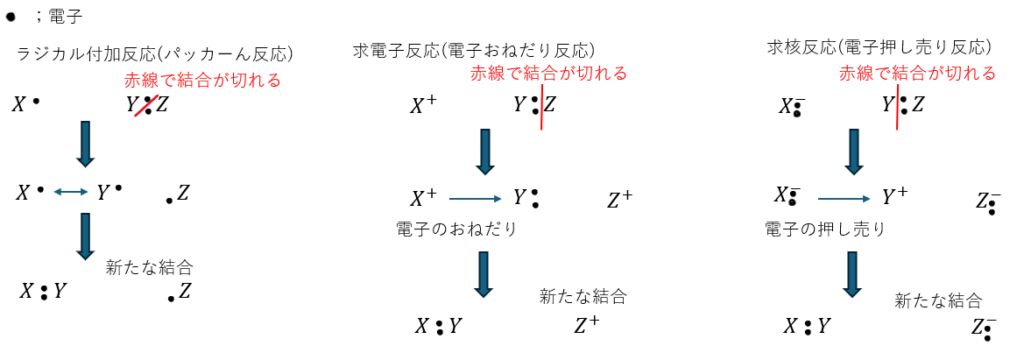
まず、有機化学には3つの反応があることを以下の記事でも話しました。
念のために復習しておきます。
- ラジカル反応 (パッカーん反応)
- 求電子反応 (電子おねだり反応)
- 求核反応 (電子押し売り反応)
求電子置換反応とは、陽イオンがベンゼンの二重結合の電子を求めてベンゼンにアタックすることです。
これによってベンゼンが水素原子を1つ切り離して陽イオンと結合することで求電子置換反応が終了します。
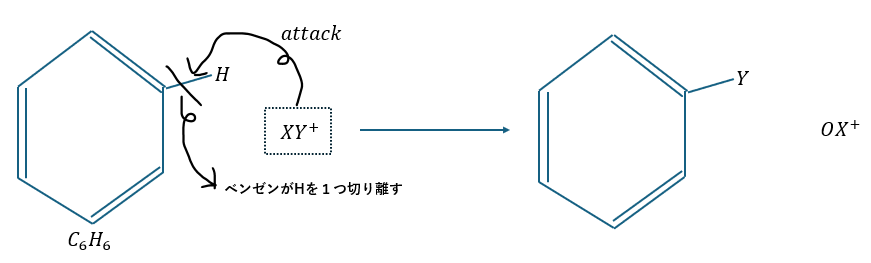
この反応を成功させるためには陽イオンが必要です。
今回紹介するクロロ化なら塩素(Cl)の一価陽イオンです。
「塩素は一価の陰イオンが普通じゃね」と思う人もいるかもしれませんが、無理矢理電子を取り払えば陽イオンにすることができます。
ただ、陰イオンで安定な元素を陽イオンにすることは簡単なことではございません。
だから・・・
- 触媒を用いる
- 圧力を高圧にする
- 温度を高温にする
上の三つの条件で反応を起こします(有機化学で触媒が多く出てくるのはこれが理由)。
ベンゼンのクロロ化/アセチル化/アルキル化
ベンゼンのクロロ化/アセチル化/アルキル化について紹介します。以下の図をご確認ください。
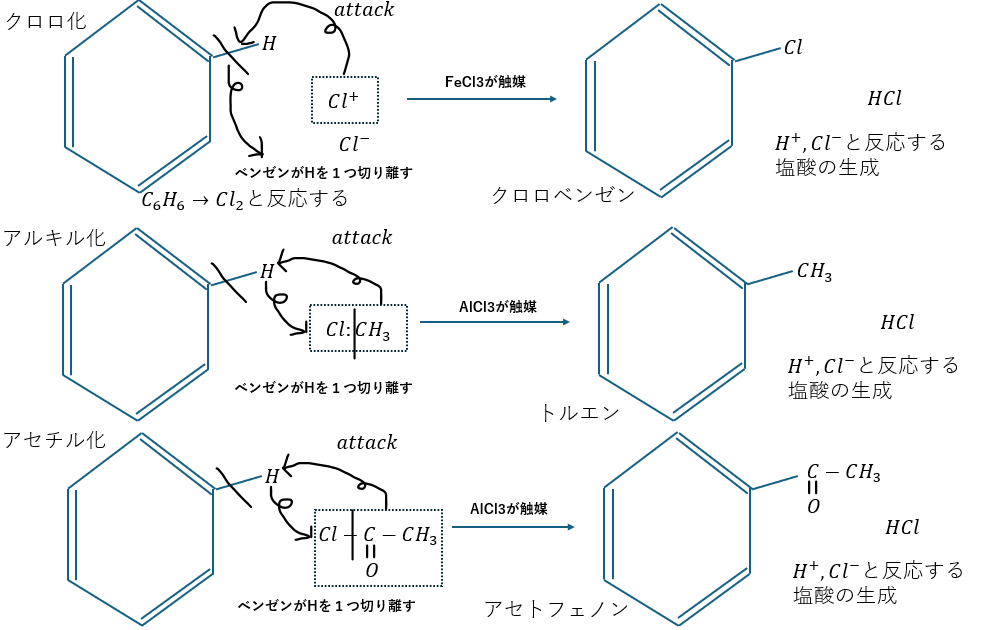
触媒の種類で塩化鉄と塩化アルミニウムがありますが、違いを解説します。
- FeCl3・・・価格は安いが触媒の性質はAlより優秀でない
- AlCl3・・・Feより優秀だが価格が高い
そのため、反応性を優先したいのであれば塩化アルミニウム、価格を優先したいのなら塩化鉄です。
また、触媒は粉状で使用します。理由は粉状の方が表面積が大きくなって反応性が増大するからです。



コメント