こんにちは。Horyです。
今回の記事ではグループ別・元素別各論として銅の製法とその化合物に関して簡単に解説します。
銅に関しても鉄と同様に金属イオンの中ではかなり厄介なので今回も頑張ってください。
銅の性質
まずは、銅の性質に関して紹介します。
- 銅の性質
- オリンピック元素と呼ばれている(メダル)
- イオン化傾向が低い
- 融点は1000℃程度
- 電気伝導性が比較的に高い
- 銅と合金について
- 白銅・・・CuにNiを10~30%混ぜる
- 黄銅(真ちゅう)・・・CuにZnを25~45%混ぜる
- 青銅(ブロンズ)・・・CuにSnを混ぜる
- ジュラルミン・・・AlにMgやCuを混ぜる (Alより強く、軽い→航空機)
銅については合金が多くややこしいです。
銅と何の金属が混ざって何になるのかを意識してください。
銅とその化合物
銅とその化合物に関して紹介します。
- Cu・・・単体
- Cu2O・・・酸化物(赤色)
- CuO・・・酸化物(黒色)
- Cu(OH)2・・・水酸化物(青白色)
- CuSO4・・・塩(白色)
- CuSO4 5H2O・・・塩 五水和物 (青色)
- Cu2CO3(OH)2・・・塩 (緑青)
- CuS・・・塩 (黒色)
- Cu(NO3)2・・・塩 (青色)
これらの化合物について以下の順番で紹介します。
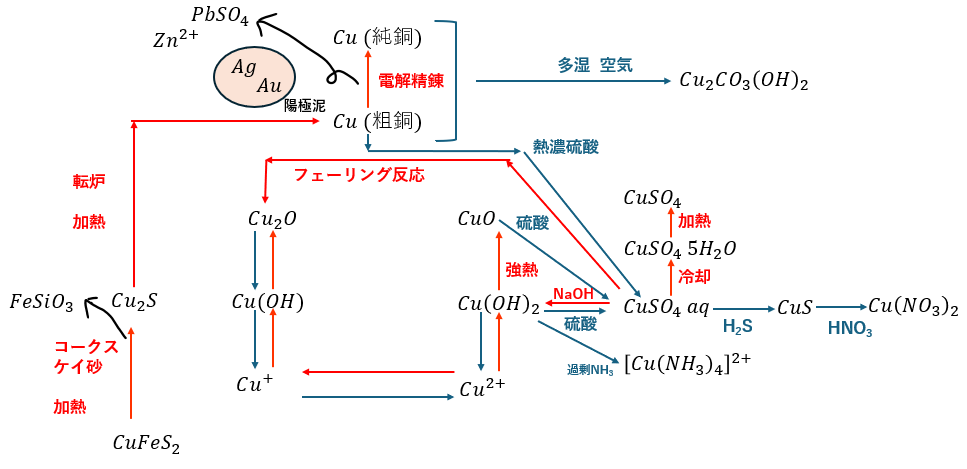
- Cu単体の精錬方法
- Cuの酸化物について
- Cuの水酸化物について
- Cuの塩について
結構多いですが頑張りましょう。
Cu単体の精錬方法
Cu単体の精錬方法に関して解説します。
製法に関して、最初は鉄とほとんど変わりませんが、その後に一手間加える必要があるので厄介です。
まず、以下の3つの素材を原料にして炉内に投入します。
- 黄銅鉱・・・CuFeS2
- コークス・・・C
- ケイ砂・・・SiO2(密度高い)
以下に図を示します。
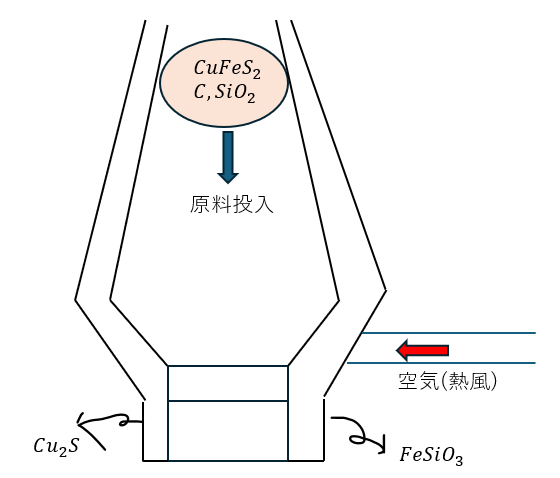
化学反応式は以下の通りです(覚えといた方が良いよ)。
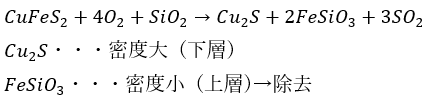
次に、生成された硫化銅を炉内に入れて燃やすことで粗銅と呼ばれる不純物の多い銅を生成します(余談ですが、下の反応で硫黄は還元剤として働きます)。
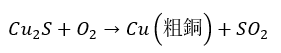
最後に粗銅を陽極、純銅を陰極にして電気分解を行うと粗銅よりもイオン化傾向の小さい金属(不純物)が単体となって沈殿します。
これを陽極泥と呼びます。電気分解の様子を図に示します。
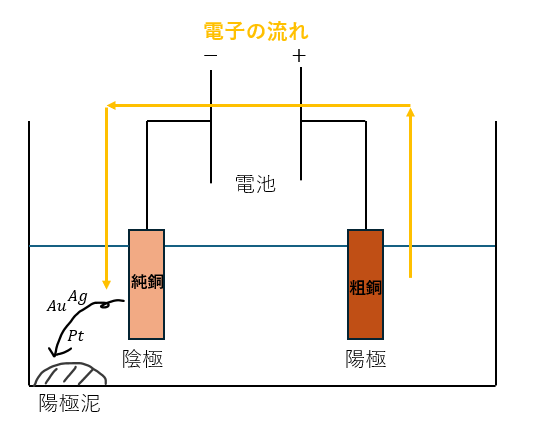
粗銅を純銅にする作業を銅の電解精錬と言って、電解精錬の陽極泥に関する計算問題は応用問題として出るので慣れておくと良いです。
Cuの酸化物・水酸化物について
- CuO・・・Cu(OH)2の強熱
- Cu2O・・・CuSO4水のフェーリング反応(有機で説明)
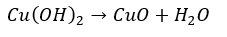
一方で水酸化物はCu(OH)21つしかありません(CuOHはあるものの、見ることがほとんどない)。
これは、硫酸銅水(CuSO4 aq)にNaOHを投入することで作ることができます。
Cuの塩について
- CuSO4・・・CuSO4 5H2Oを強熱して水和水を除去
- CuSO4 5H2O・・・CuSO4 水を冷却
- CuSO4 水・・・Cu(OH)2に硫酸を投入
- Cu2CO3(OH)2・・・Cuが湿気のある環境で自然酸化 (10円玉の錆みたいな)
- CuS・・・CuSO4 水にH2Sを投入
- Cu(NO3)2・・・CuSにHNO3を投入
まとめ
銅とその化合物に関して図にまとめます。



コメント