こんにちは。Horyです。
今回はグループ別・元素別各論で鉄の製法と鉄の化合物に関して簡単にまとめます。
鉄は単体の製法を初めとして化合物などはややこしいので今回の記事の内容は結構重要です。
今回も頑張りましょう。
鉄の性質
遷移元素でFe(鉄)、Co(コバルト)、Ni(ニッケル)は周期表の真ん中にある元素で以下の特性を持ちます。
- 融点がとても高く1500℃程度
- 酸性に強い・・・濃硝酸や濃硫酸で不動態を形成
- 鉄は温度上昇と共に構造変化・・・体心→面心→体心
- 強磁性体である
- 合金について・・・
- ステンレス鋼・・・鉄にクロムを質量比10%程度で混ぜる
- 白銅・・・銅に質量比10~30%のニッケルを混ぜる
- 鉄とメッキについて・・・
- ブリキ・・・鉄表面に鉄よりイオン化傾向の小さいスズをメッキ
- 長所・・・内部の鉄が錆びにくい
- 短所・・・傷つくと鉄が露出して錆びる
- トタン・・・鉄表面に鉄よりイオン化傾向の大きい亜鉛をメッキ
- 長所・・・傷ついても鉄の身代わりとして亜鉛が錆びる
- 短所・・・表面は錆びやすい
- ブリキ・・・鉄表面に鉄よりイオン化傾向の小さいスズをメッキ
合金とメッキについては知識問題としてよく出るので覚えておいた方が良いです。
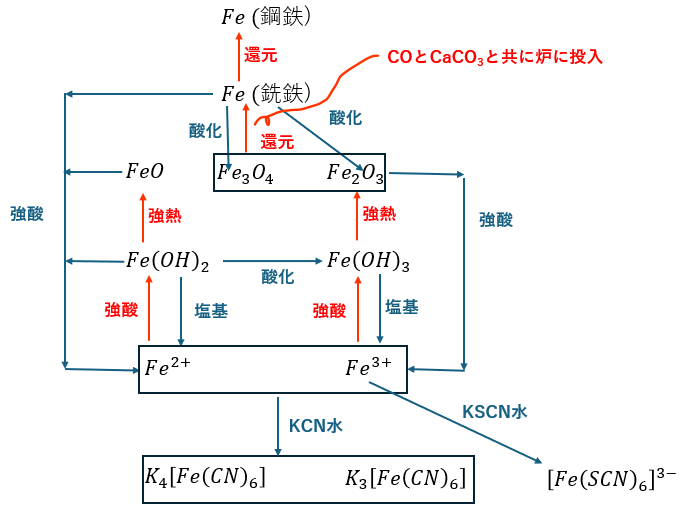
鉄とその化合物
今回の記事で習得する鉄とその化合物に関して簡単にまとめます。
- Fe;鉄・・・単体
- FeO;酸化鉄(Ⅱ)・・・酸化物(緻密な酸化皮膜=さび止め)
- Fe2O3;三酸化二鉄(赤鉄鉱)・・・酸化物
- Fe3O4;四酸化三鉄(磁鉄鉱)・・・酸化物
- Fe(OH)2;水酸化鉄(Ⅱ)
- Fe(OH)3;水酸化鉄(Ⅲ)
これらについて、以下の順で紹介していきます。
- 鉄の精錬・・・鉄単体の作り方を通して酸化物を解説
- 鉄の水酸化物の紹介
- 鉄イオンと借イオンについて
鉄の精錬方法
鉄の精錬の原料は以下の通りです。
- 原料
- Fe2O3;三酸化二鉄(赤鉄鉱)・・・Fe(OH)3の脱水
- Fe3O4;四酸化三鉄(磁鉄鉱)・・・2価:3価=1:2
- コークス;C
- 炭酸カルシウム;CaCO3
ちなみに、赤鉄鉱と磁鉄鉱が混ざった物が鉄鉱石です。
上の4つが入っている原料を炉に入れて下から高温・高圧の空気を入れることで鉄単体を精錬します。
以下に図を示しマス。
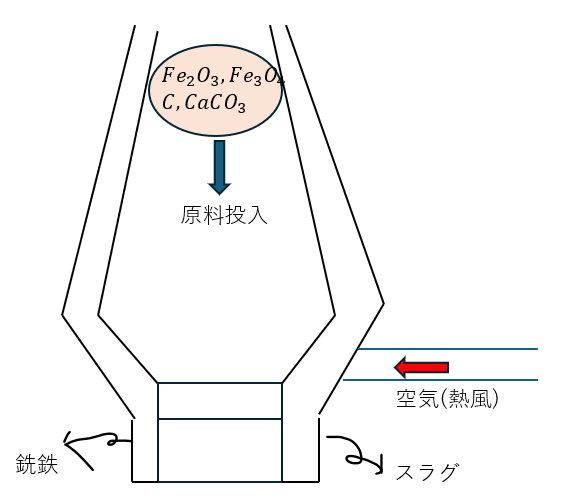
ここで、今回は赤鉄鉱のみを溶鉱炉に入れたとして化学反応式を示します。

ところで、炭酸カルシウムが出てきていませんが、何の役に立っているのでしょうか?
実は、上の溶鉱炉で鉄を作るときに二酸化ケイ素(SiO2)等の不純物ができてしまいます。
これを取り除くために炭酸カルシウムがあるのです。

ちなみに、密度の違いから・・・
- 鉄・・・銑鉄(炭素が4%)で下に出てくる
- スラグ・・・上に出てくる
銑鉄には炭素が4%入っています。
そのため、銑鉄を転炉に入れて酸素を吹き込むことで炭素の含有量を(0.3~2%)にまで減らすことができます。
これが鋼鉄と呼ばれている物です。
水酸化物について・・・
水酸化物は鉄の二価イオンと三価イオンで分かれます。
- Fe(OH)2・・・鉄の二価イオン水溶液にNH3水かNaOH水を入れる
- Fe(OH)3・・・Fe(OH)2を水中で酸化 or 鉄の三価イオン水溶液にNH3水かNaOH水
沈殿の色は上から順に緑白色、褐色です。覚えといてください。
鉄イオンと借イオンについて
- 鉄イオンについて・・・
- 二価イオン・・・酸化物/水酸化物を酸性溶液に投入;淡緑色
- 三価イオン・・・酸化物/水酸化物を酸性溶液に投入;黄褐色
- 借イオン沈殿について
- 二価イオンにKCN→K4[Fe(CN)6]・・・濃青色沈殿
- 三価イオンにKCN→K3[Fe(CN)6]・・・濃青色沈殿
- 三価イオンにKSCN→K3[Fe(SCN)6]^3-・・・血赤色
まとめ
鉄とその化合物に関して図にまとめます。



コメント