こんにちは。Horyです。
今回の記事はグループ別・元素別各論における窒素に関して解説します。
窒素は空気中に78%含まれる気体で、以下の2つの気体の製法は非常に重要です。
- ハーバー・ボッシュ法⇔窒素からアンモニアを作る
- オストワルド法⇔アンモニアを起点として硝酸を作る
今回も頑張りましょう。
窒素とその化合物について・・・
窒素とその化合物に関して簡単にまとめます。
- 窒素(N2)・・・空気中に78%
- アンモニア(NH3)・・・弱塩基性で肥料の原料
- 硝酸(HNO3)・・・強酸酸化剤
これらについて以下の順で解説していきます。
- アンモニアとハーバー・ボッシュ法
- 硝酸とオストワルト法 (ついでに窒素酸化物を紹介)
アンモニアとハーバー・ボッシュ法
アンモニアの特性を詳しく記述します。
- アンモニアの特性
- 分子の形状は正三角錐型
- 弱塩基性を示す (気体で塩基性はアンモニアだけ)
- 水によく溶ける
- 肥料の材料である
アンモニアはハーバー・ボッシュ法で生成されて、化学反応式は以下になります。
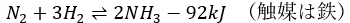
ちなみに、窒素と水素が1:3でアンモニアが2できる式に見えますが、これは可逆反応であることを忘れてはいけません。
つまり、条件とかを非常に厳しくしないと予定量のアンモニアを取得することはできないのです。
ハーバーとボッシュはアンモニアを最大限取得する条件を解明したことでノーベル化学賞を取りました。
ちなみに、どういう条件にしないといけないかというと・・・
- 圧力をとても高くする (大気圧の200~1000倍)→反応が右に
- 温度を低くする (ただ、反応速度を確保するために500℃程度)→反応が右に
ハーバー・ボッシュ法は化学平衡の問題でも出ます。化学平衡の記事は以下に示すとおりです。
ちなみに、アンモニアは肥料の原料になりますが、アンモニアで製造される肥料は・・・
- 硫酸アンモニウム・・・(NH4)2SO4
- 硝酸アンモニウム・・・NH4NO3
- 尿素・・・(NH2)2CO
ハーバー・ボッシュ法によりアンモニアの安定した大量生産が可能になったことで肥料が大量生産可能になって農作物を安定して育てることができるようになったのです。
硝酸とオストワルド法
硝酸とオストワルト法についてです。
アンモニアを起点として3段階の反応が行われます。

ちなみに、冷水と反応させてしまうと得られる硝酸の量が少なくなってしまいます。
これは、こちらの記事でも解説しました。
ちなみに、窒素酸化物は酸性雨の原因にもなっています。
まとめ
窒素とその化合物に関してまとめます。
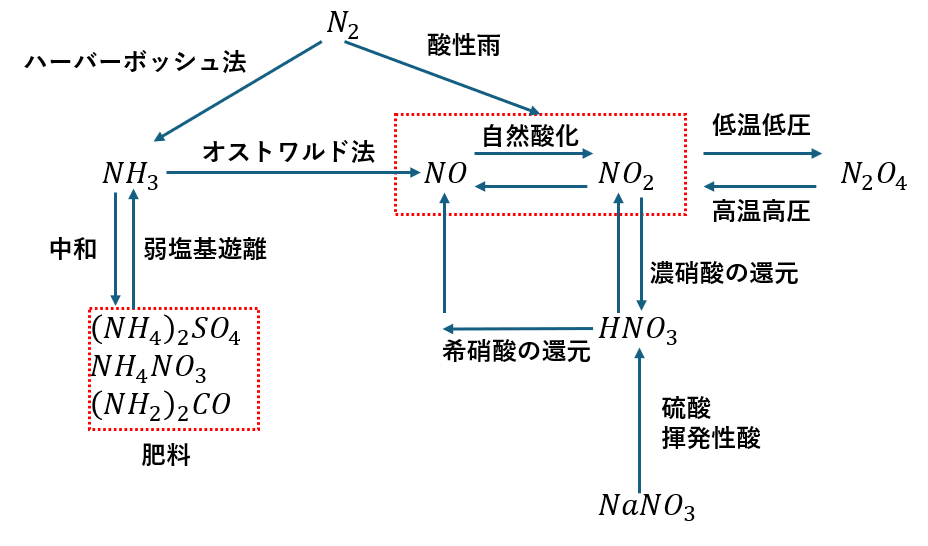
- 希硝酸を還元して一酸化窒素を得る反応式
- 濃硫酸を還元して二酸化窒素を得る反応式
上の2つの反応式は覚えにくいだけに頻出します。
化学反応式自体は前回の記事に載っているのでよく見といてください。



コメント