こんにちは。Horyです。
今回の記事ではグループ別・元素別各論で亜鉛とその化合物について解説しようと思います。
今回も頑張りましょう。
亜鉛とその化合物について・・・
亜鉛は12族の金属元素です。
12族は今までは典型元素に含まれましたが、最近の指導要領改訂により遷移元素に属すことになりました。
- 亜鉛の特徴
- 重金属で融点は420℃
- 六方最密構造
- 高温の水蒸気と反応
- 両性元素
- Zn;亜鉛・・・単体
- ZnO;酸化亜鉛・・・酸化物
- Zn(OH)2;水酸化亜鉛・・・水酸化物
- ZnS;硫化亜鉛・・・塩
- ZnCl2;塩化亜鉛・・・塩
これらについて個別に解説していきます。
単体の亜鉛について・・・
単体の亜鉛をどうやって作るかについてですが、硫化物を利用します。
硫化亜鉛を一酸化炭素で還元することで亜鉛の単体を得ることができます。
まぁ、反応が二段階で厄介ですが、一度強熱して酸化亜鉛にする作業を挟みます。
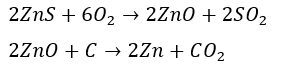
ちなみに、硫化亜鉛は元となる鉱物の閃亜鉛鉱を用います。
閃亜鉛鉱の構造はこちらに示していますので良かったら見といてください。
酸化亜鉛について・・・
酸化亜鉛の作り方は主に2つです。
- 亜鉛を酸素で酸化する
- 水酸化亜鉛を強熱する
上から順番に化学反応式を示します。

水酸化亜鉛について・・・
水酸化亜鉛の作り方は主に2つで、どちらも塩化亜鉛が基点になります。
- 塩化亜鉛をアンモニア水に投入
- 塩化亜鉛を水酸化ナトリウム水に投入
ちなみに、過剰に投入してはいけないです。
過剰に投入すると借イオンになって沈殿しません。
硫化亜鉛について・・・
硫化亜鉛は硫化物の沈殿の中で白色と言うことを覚えておいてください(硫化物の沈殿はほとんど黒色)。
作り方は以下の2つです。
- 塩化亜鉛に硫化水素を吹き込む
- 借イオンにアンモニアによる弱塩基条件で硫化水素を吹き込む
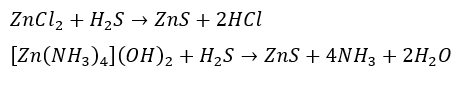
塩化亜鉛について・・・
塩化亜鉛の作り方は主に3つです。
その全てにおいて塩酸が絡みます。
- 亜鉛に塩酸を投入
- 酸化亜鉛に塩酸を投入
- 水酸化亜鉛に塩酸を投入
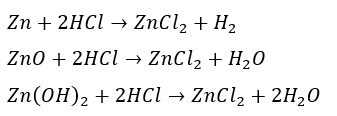
借イオンについて
借イオンについてですが、亜鉛の借イオンは主に2つです。

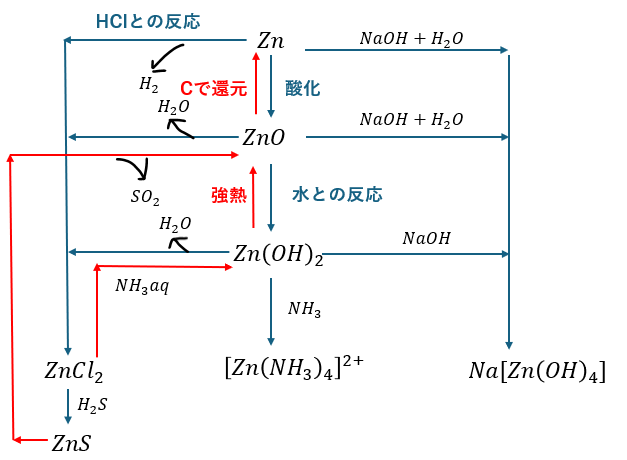
まとめ
亜鉛とその化合物に関してまとめます。



コメント