こんにちは。Horyです。
今回からグループ別・元素別各論という分野に入っていきます。
これまでのイオン化傾向や気体の反応は無機化学の元素について広く浅く見ていくという感じでした。
一方で、グループ別・元素別各論はいくつかの元素について狭く深く見ていくというイメージです。
- イオン化傾向/気体生成・・・ライン技術
- グループ別/元素別・・・要素技術
今回はグループ別・元素別各論の第一歩としてアルカリ金属について見るとともに、その中でも特に大事なナトリウムとソルベー法に関してまとめたいと思います。
今回も頑張りましょう。
アルカリ金属について・・・
アルカリ金属で私たちが頭に入れておいた方がいいものはLi, K, Rb, Cs, Frとなります。
性質を箇条書きでまとめていきます。
- 最外殻電子は1つ・・・結合が弱く柔らかい・融点も低い
- 密度が低い・・・軽金属で体心立方格子
- 水と反応して水酸化物 (塩基性)
- 石油中に保存せよ (理由は有機化学で記述)
上の性質を頭に入れとけば大丈夫です。アルカリ金属の中で特に重要なものはNa(ナトリウム)です。
ナトリウムとその化合物に関して簡単に解説します。
Na(ナトリウム)について・・・
ナトリウムについて、学ぶべき化合物に関して簡単にまとめます。
- Na・・・ナトリウム→単体
- NaOH・・・水酸化ナトリウム(苛性ソーダ)→水酸化物
- NaCl・・・塩化ナトリウム→塩
- NaHCO3・・・炭酸水素ナトリウム(重曹)→塩
- Na2CO3・・・炭酸トリウム(ソーダ灰)→塩
基本的にこれらの化合物を作るとき、全て塩化ナトリウムを起点として作られることを覚えておいてください。
水酸化ナトリウムについて・・・
水酸化ナトリウムについてです。
この化合物は工業的にも非常に利用されています。
作り方は主に以下に示す2つです。
- 塩化ナトリウム水溶液の水溶液電解・・・欠陥あり
- イオン交換膜を用いた水溶液電解・・・上の改良
これらについて個別に解説します。
余談ですが、水酸化ナトリウム結晶を空気中に放置でNaOH水になります。
この現象を潮解と呼びます。
電気分解について・・・
多くの人が勘違いしている電気分解について話します。
化学の電気分解は外部の電池に陽極と陰極の極板を付けて電気分解を行います。
ここで、「電子は電池の負極→正極へ流れる」というのは正しいですが、念のために言葉の定義をしておきます。
- 正極・・・外部電池の+側
- 負極・・・外部電池の-側
- 陽極・・・正極につながれた極板
- 陰極・・・負極につながれた極板
電子の流れは「陽極→正極→負極→陰極」です。
一方で、電流の流れは「高電位→低電位」です。
なので、陽極では電子を放出する酸化反応が起こって、陰極では電子を受け取る還元反応が起こります。
これを頭に入れておいてください。
NaCl水溶液の水溶液電解
水溶液電解について、図を用いて説明します。
以下の図のように陽極から陰極へ電子が移動すると考えて、陽極と陰極のイオン反応式を示します。
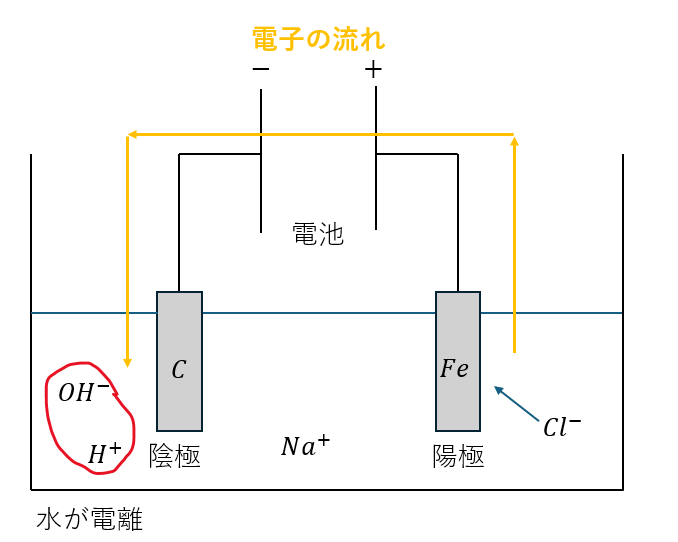
なので、陽極と陰極のイオン反応式は以下に示すとおりです。
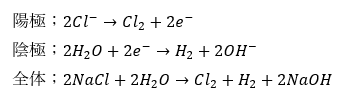
上に示すように水酸化ナトリウムが生成して実験成功と思うかもしれませんが、このやり方には欠陥があります。
塩素が水と反応するとどうなるでしょうか・・・
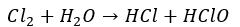
塩素は水と反応すると塩酸や次亜塩素酸を生成し、これは酸性物質です。
塩基性の水酸化ナトリウムと反応してしまいます。
イオン交換膜による改良
上に示した欠陥を克服したものが陽イオン交換膜を応用した電気分解です。
図を示します。
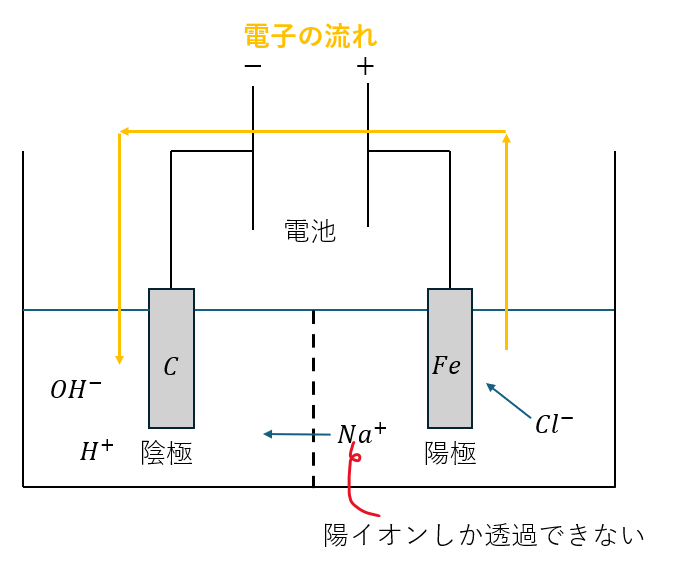
上のように陽イオンしか通過できない仕切り作ると・・・
- ナトリウムイオンが陰極側に
- 陰極の水酸化イオンと反応
- 陰極側で水酸化ナトリウム
- (一方で、陽極側の塩酸や次亜塩素酸とは反応しない)
このように、水酸化ナトリウムのみを取り出せるという寸法です。
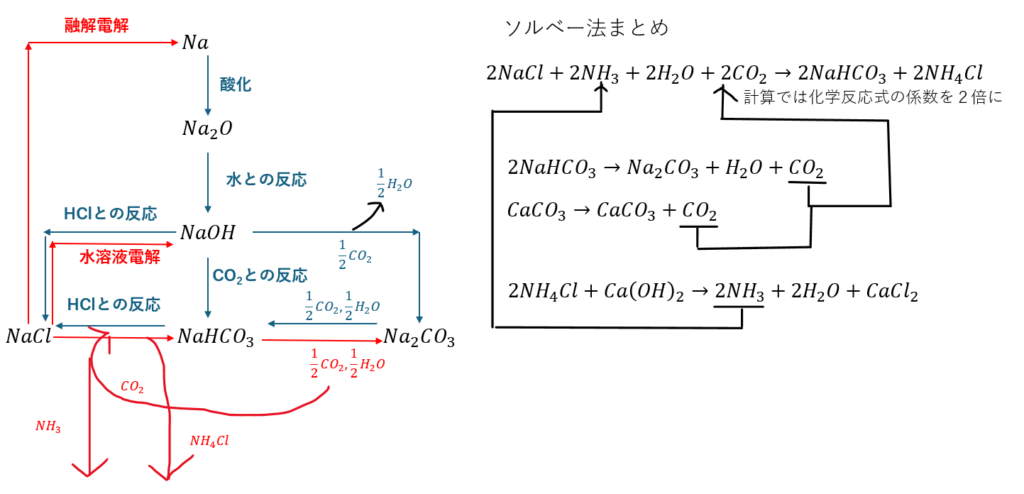
単体のナトリウムについて・・・
単体のナトリウムは塩化ナトリウムの融解電解で得ることができます。
融解電解って何なんだ?と思うかもしれませんが、原理は簡単です。
先ほどの水酸化ナトリウムの製造ではナトリウムイオンを水の電離による水酸化物イオンと反応させて水酸化ナトリウムを得ました。
ナトリウム単体を得たいなら、水が邪魔なわけです。
だから、容器いっぱいに塩化ナトリウムを入れて、800℃ほどで溶かして電気分解するわけです。
ちなみに、実際は凝固点降下に塩化カルシウムを入れて600℃ほどで溶かしています。
カルシウムは析出しないの?と思うかもしれませんが、安心してください。
イオン化傾向がナトリウムよりも低いのでイオンのままです。
炭酸水素ナトリウムと炭酸ナトリウム
炭酸水素ナトリウムと炭酸ナトリウムはソルベー法(アンモニアソーダ法)という手法を用います。
これは、電気分解を使わないのでコストを低減できます。
具体的にはNaClとNaHCO3の溶解度の差を利用します。どういうことかというと・・・
- NaCl・・・NaHCO3より5倍溶ける
- NaCl中に大量のNaHCO3
- 重炭酸イオン(HCO3^-)が溶液中に大量存在
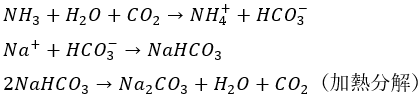
炭酸ナトリウムはガラスの原料として使います。
余談ですが、水和物Na2CO3・10H2Oを空気中に放置するとNa2CO3・H2Oに変化します。
この現象を風解と呼びます。
まとめ
ナトリウムの化合物とソルベー法について簡単にまとめます。



コメント