こんにちは。Horyです。
前回の記事では原子半径やイオン半径についての原理を簡単に解説するとともに、周期表における規則性について考えました。
今回の記事では、イオン化エネルギーと電子親和力に関して解説する(この両者について、名前は知っているけど完璧に説明できるという人はほとんどいないと考えています)ともに、周期表における規則性を考えたいと思います。
今回も頑張りましょう。
イオン化エネルギー
イオン化エネルギーとは、「原子から電子を無限遠まで話して一価の陽イオンにするために必要なエネルギー」のことです。
電子は原子核に引き付けられます。これを引き離して一価の陽イオンにするためにはエネルギーが必要なのです。
だから・・・
- イオン化エネルギーが小さい→陽イオンになりやすい
- イオン化エネルギーが大きい→陽イオンになりにくい
イオン化エネルギーの定義は以下の通りです。
原子正体の元素Mを一価の気体の陽イオンにすることを考え、必要なエネルギーをEaとすると・・・
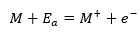
上の式のEaが(第一)イオン化エネルギーと呼ばれるものです。
イオン化エネルギーの周期性
典型元素におけるイオン化エネルギーの周期性を考えます。
説明をする前に、有効検電荷についてはこちらの記事で説明していますので読んでおいてください(この記事では説明しません)。
また、原子核と電子に働くクーロン力(引力で引き合う力)は以下の式のように書けます。
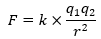
これらの前提知識をもとに典型元素のイオン化エネルギーの周期性に関して解説します。
同一族・・・イオン化エネルギーは原子番号が大きくなると小さくなる
- 何故?・・・
- 同一族では原子の有効検電荷は同じ
- だが、電子殻がK,L,M・・・になるにつれて原子半径は増加
- クーロン力の式から最外殻と原子核の距離rが増加するにつれてクーロン力は減少
- だから原子から電子を一つ取り払うためのエネルギーは小さくなる
同一周期・・・イオン化エネルギーは原子番号が大きくなると大きくなる
- 何故?・・・
- 同一周期だと原子半径はほぼ変わらない
- だが、有効検電荷は変わる。
- 原子番号が増加すると有効検電荷の数値も増える。
- クーロン力において、原子核のもつ電荷qが大きくなることでクーロン力が増加
- だから、電子を一つ取り払うためのエネルギーは大きくなる。
このように考えると周期表におけるイオン化エネルギーが以下のように考えることができます。
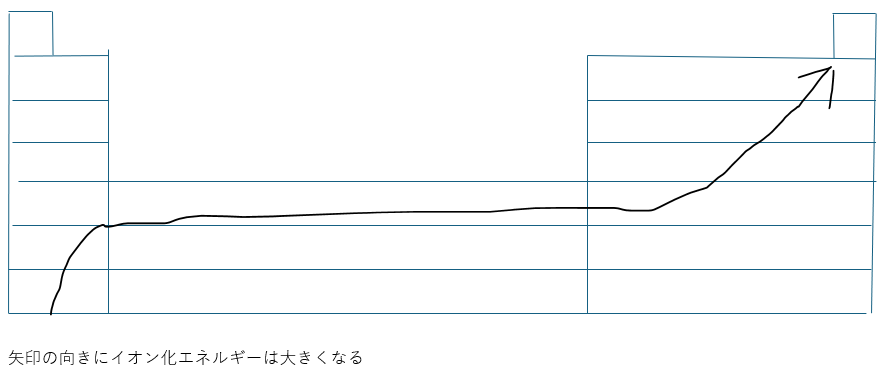
図における矢印の向きにイオン化エネルギーは大きくなります。
また、横軸に原子番号・縦軸にイオン化エネルギーをとってグラフにすると周期ごとで比較するとグラフの形状が似通ったものになると思います(調べてみてください)。
イオン化エネルギーを分かりやすく説明すると、イオン化エネルギーは「各原子が所有している電子に対してどの程度、思い入れがあるかを示す数値」になります。
- イオン化エネルギー小さい・・・電子への思い入れ小さい
- イオン化エネルギー大きい・・・電子への強い思い入れ
電子親和力
電子親和力とは、「電気的に中性な原子が電子を受け取って一価の気体の陰イオンになるとエネルギーを放出することで発熱する。この時の発熱量を電子親和力という」
どういうことかというと、電子を取り去るにはエネルギーを加える必要があります。逆に、電子を与えるときはエネルギーを放出する必要があります。
電子親和力の定義は以下の通りです。
原子正体の元素Mを一価の気体の陰イオンにすることを考え、必要なエネルギーをFaとすると・・・
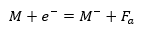
上の式のFaを電子親和力といいます。
- 電子親和力が大・・・陰イオンになりやすい
- 電子親和力が小・・・陰イオンになりにくい
電子親和力の周期性
電子親和力にも周期性がありますが、これは、イオン化エネルギーの周期性と似ています(ただ、完全一致ではないのでそこは注意)。
ただ、注意してほしいのが、イオン化エネルギーと比較して電子親和力の大きさは小さいです。
- 希ガス・・・電子親和力は0に近い
- ハロゲン(17族)・・・電子親和力が極めて大きい (陰イオンになりやすい)
何でか自分で考えてみてください。有効検電荷とクーロン力の定義式を考えれば分かるはずです。
- 同一族・・・原子半径の変化でクーロン力(他の原子が持つ電子を引き付ける)どうなる?
- 同一周期・・・有効検電荷の変化でクーロン力どうなる?
電子親和力を分かりやすく説明すると、「原子が他の電子をどの程度所有したいかを数値化したもの」と言い換えることができます。


コメント