こんにちは。Horyです。
前回の記事では反応速度についてまとめるとともに、反応速度を速くするにはどうすればいいかということを解説しました。
今回の記事では反応速度式について解説するとともに、それを問題にどういう風に応用するかを話します。
今回も頑張りましょう。
反応速度式について・・・
まず、元素をA,B,Cとおいて、自然数をα,β,γと置いて、「αA+βB→γC」のような化学反応式があったとしたら、反応速度は以下のように表されます。

また、このような分解反応「αA→βB」であれば・・・

ところで、kというのは反応速度係数とよばれているもので、以下のように表されます。

上の式をよく考えてください。
反応速度を増加させるには反応速度定数kを増加させればいいです。
そのためには (-E/RT)をどうするかですが・・・
- 温度を上げる→(-E/RT)が増加→反応速度定数が増加→反応速度増加
- 活性化エネルギー減少→(-E/RT)が増加→反応速度定数が増加→反応速度増加
前回の記事で言ったことですが、アレニウスの式に当てはめたら、その通りになっていますね。
実際に温度が10K増加すると反応速度係数が3倍になる反応があるとして、温度が40Kになったらどうなるかを考えてみます。
間違えても、温度が4倍になるから4倍とかやらないでくださいね!
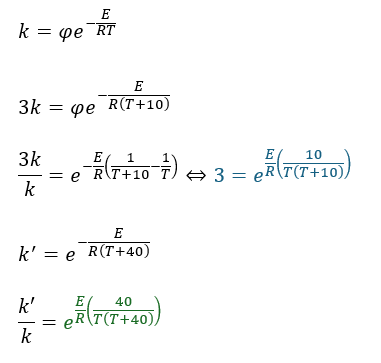
ここで、TもT(T+10)もT(T+40)も一定と見なしてしまうと・・・

だから、81倍になります。
もしも、温度が10K増加して2倍になったら、40Kで16倍になります。
ただ、ちょっと待ってください。上の証明っておかしくないですか?
だって、証明の仮定で指数の肩の数字の分母のTもT(T+10)もT(T+40)も一定と見なしているからです。
これについてですが、そもそも、アレニウスの式自体は経験則に基づいた公式(温度が10K上がると反応速度が2~3倍になることが実験を何度もやって判明した)です。
だから、ある程度は近似を許している側面があります。
だから、問題に出たときは、素直に温度が10K上がって反応速度が2倍になるとかだったら、素直に20K,30K上がったときの反応速度は「2^2=4倍」・「2^3=8倍」になると考えてください。
反応速度 過酸化水素の分解
反応速度に関する問題で過酸化水素の分解に関するものに取り組みます。

この問題を例に解説します。頑張りましょう。
(1)解答・解説
(1)の解答・解説になります。
高校化学における反応速度は特定の時間における平均の速度です。
また、この問題では、平均の速度を平均の濃度で割り算した値が反応速度係数kになりますが、これが一定値になれば良いのではないでしょうか?

これを用いてkがどの時間帯でも同じような値であれば1次反応と言えます。
(2)解答・解説
(2)の解答解説に移ります。素直に式に温度と反応定数を代入します。
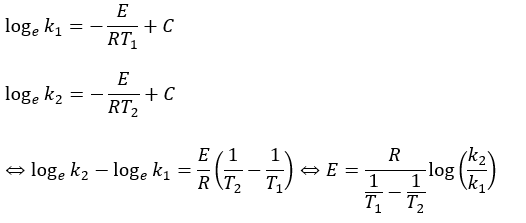
余談;一次反応と二次反応の違い
一次反応と二次反応の違いを解説します。
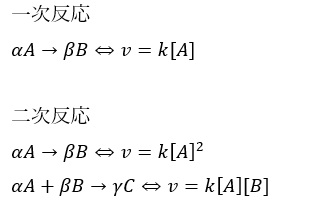
- 一次反応・・・反応速度は反応物の濃度に比例
- 二次反応
- ・・・反応速度が反応物の二乗に比例
- ・・・反応速度が2つの反応物の積に比例



コメント